- Теплофизические свойства и температура замерзания водных растворов NaCl и CaCl2
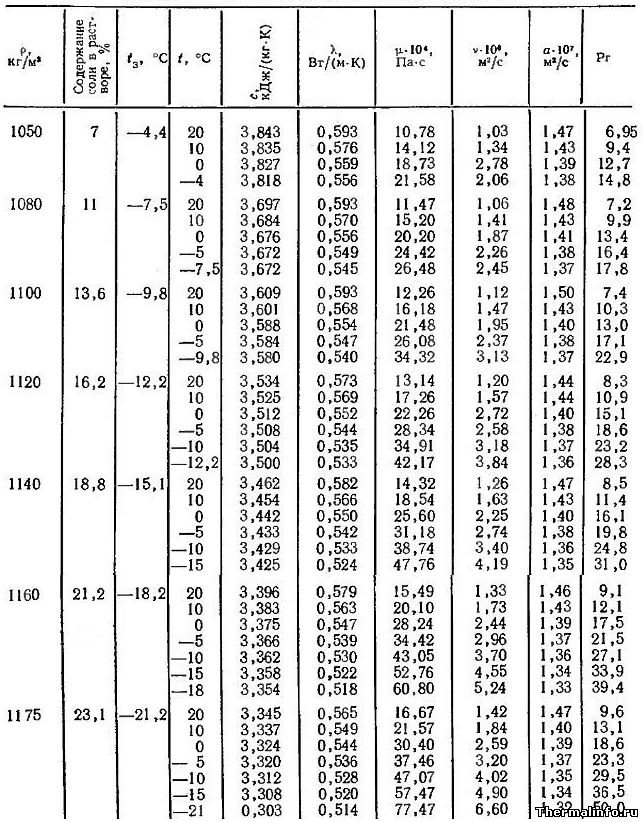
- Теплофизические свойства раствора CaCl2 (кальций хлористый)
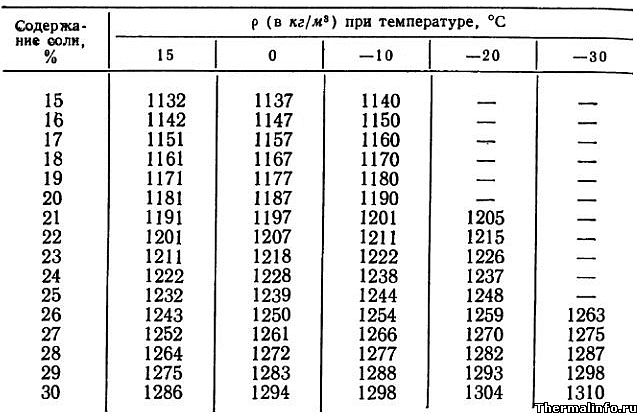
- Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
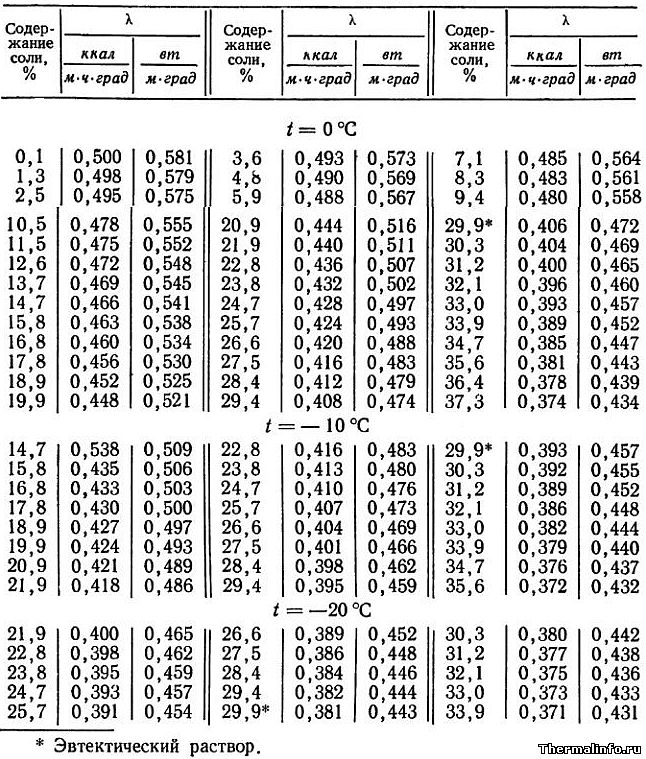
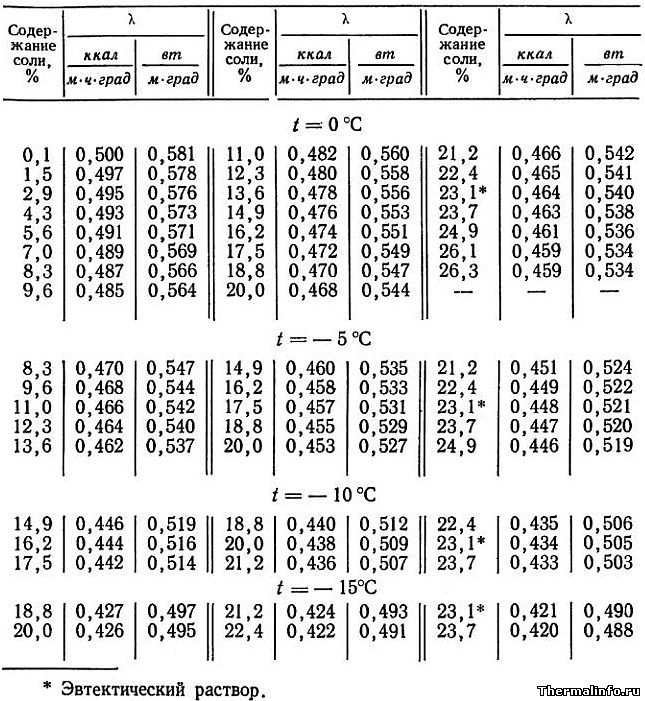
- Теплопроводность раствора CaCl2 в зависимости от температуры
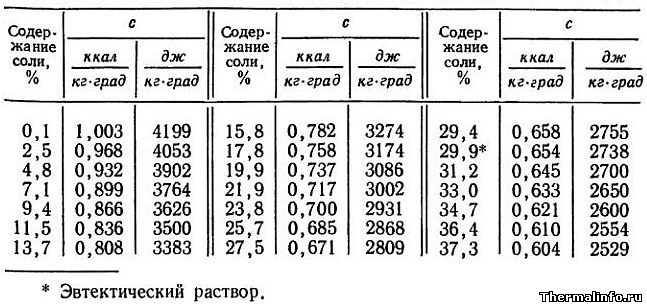
- Теплоемкость раствора CaCl2 при 0°С
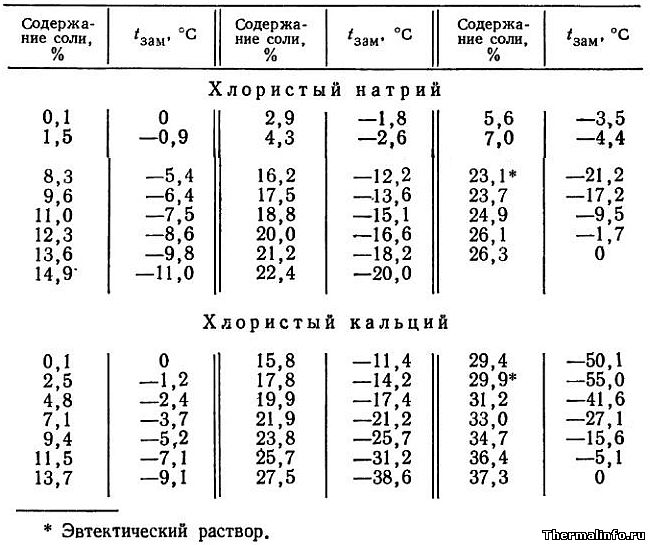
- Температура замерзания растворов солей NaCl и CaCl2
- Плотность раствора NaCl в зависимости от температуры
- Теплопроводность раствора NaCl в зависимости от температуры
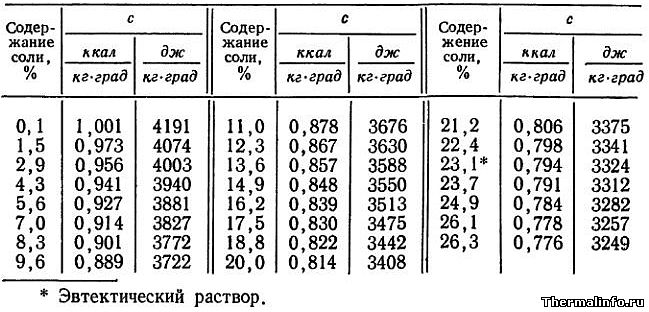
- Удельная теплоемкость раствора NaCl при 0°С
- Теплофизические свойства раствора NaCl
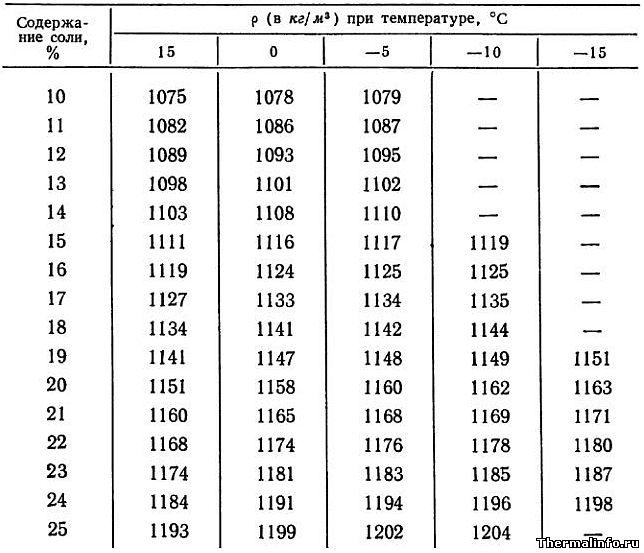
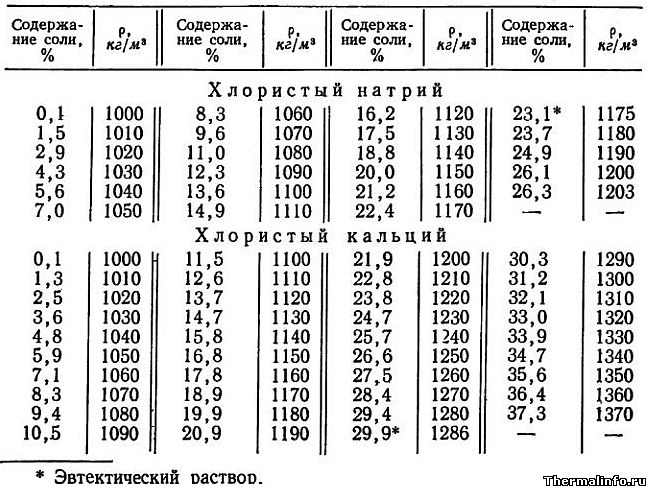
- Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
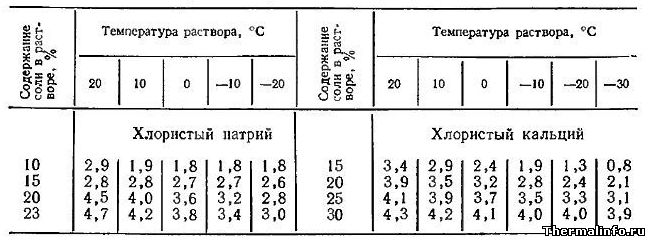
- Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
- Натрий. Вред и польза соли.
- Температурная депрессия раствора хлорида натрия
Теплофизические свойства и температура замерзания водных растворов NaCl и CaCl2
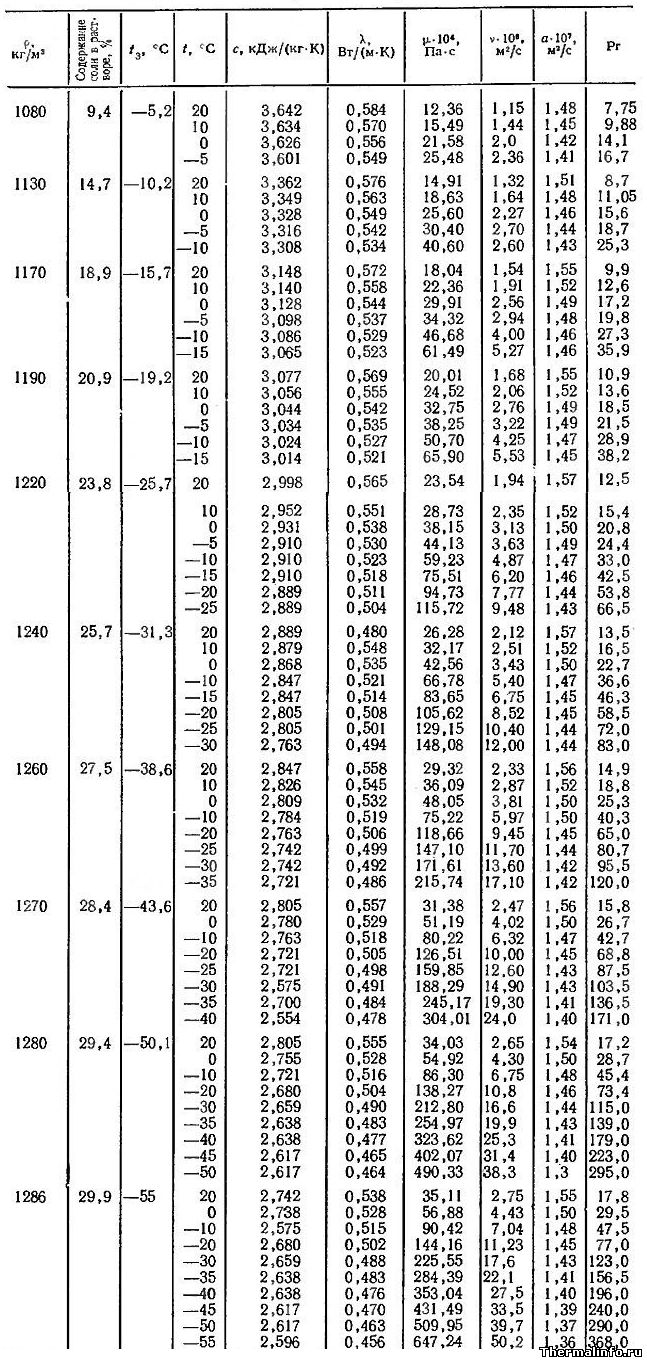
Теплофизические свойства раствора CaCl2 (кальций хлористый)
В таблице представлены теплофизические свойства раствора хлористого кальция CaCl2 в зависимости от температуры и концентрации соли: удельная теплоемкость раствора, теплопроводность, вязкость водных растворов, их температуропроводность и число Прандтля. Концентрация соли CaCl2 в растворе от 9,4 до 29,9 %. Температура, при которой приведены свойства определяется содержанием соли в растворе и находится в диапазоне от -55 до 20°С.
Водный раствор хлорида кальция CaCl2 может не замерзать до температуры минус 55°С. Для достижения этого эффекта концентрация соли в растворе должна быть 29,9%, а его плотность составит величину 1286 кг/м 3 .
При увеличении концентрации соли в растворе увеличивается не только его плотность, но и такие теплофизические свойства, как динамическая и кинематическая вязкость водных растворов, а также число Прандтля. Например, динамическая вязкость раствора CaCl2 с концентрацией соли 9,4 % при температуре 20°С равна 0,001236 Па·с, а при увеличении концентрации хлорида кальция в растворе до 30% его динамическая вязкость увеличивается до значения 0,003511 Па·с.
Следует отметить, что на вязкость водных растворов этой соли наиболее сильное влияние оказывает температура. При охлаждении раствора хлорида кальция с 20 до -55°С его динамическая вязкость может увеличиться в 18 раз, а кинематическая — в 25 раз.
Даны следующие теплофизические свойства раствора CaCl2:
- плотность раствора, кг/м 3 ;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость водных растворов, Па·с;
- кинематическая вязкость раствора, м 2 /с;
- коэффициент температуропроводности, м 2 /с;
- число Прандтля.
Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
В таблице указаны значения плотности раствора хлористого кальция CaCl2 различной концентрации в зависимости от температуры.
Концентрация хлорида кальция CaCl2 в растворе от 15 до 30 % при температуре от -30 до 15°С. Плотность водного раствора хлористого кальция увеличивается при снижении температуры раствора и увеличением в нем концентрации соли.
Теплопроводность раствора CaCl2 в зависимости от температуры
В таблице представлены значения теплопроводности раствора хлористого кальция CaCl2 различной концентрации при отрицательных температурах.
Концентрация соли CaCl2 в растворе от 0,1 до 37,3 % при температуре от -20 до 0°С. По мере роста концентрации соли в растворе его теплопроводность снижается.
Теплоемкость раствора CaCl2 при 0°С
В таблице представлены значения массовой теплоемкости раствора хлористого кальция CaCl2 различной концентрации при 0°С. Концентрация соли CaCl2 в растворе от 0,1 до 37,3 %. Следует отметить, что с повышением концентрации соли в растворе, его теплоемкость снижается.
Температура замерзания растворов солей NaCl и CaCl2
В таблице приведена температура замерзания растворов солей хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации соли. Концентрация соли в растворе от 0,1 до 37,3 %. Температура замерзания солевого раствора определяется концентрацией соли в растворе и для хлорида натрия NaCl может достигать значения минус 21,2°С для эвтектического раствора.
Необходимо отметить, что раствор хлористого натрия может не замерзать до температуры минус 21,2°С, а раствор хлористого кальция не замерзает при температуре до минус 55°С.
Плотность раствора NaCl в зависимости от температуры
В таблице представлены значения плотности раствора хлористого натрия NaCl различной концентрации в зависимости от температуры.
Концентрация соли NaCl в растворе от 10 до 25 %. Значения плотности раствора указаны при температуре от -15 до 15°С.
Теплопроводность раствора NaCl в зависимости от температуры
В таблице даны значения теплопроводности раствора хлористого натрия NaCl различной концентрации при отрицательных температурах.
Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре от -15 до 0°С. По данным таблицы видно, что теплопроводность водного раствора хлорида натрия снижается по мере роста концентрации соли в растворе.
Удельная теплоемкость раствора NaCl при 0°С
В таблице представлены значения массовой удельной теплоемкости водного раствора хлористого натрия NaCl различной концентрации при 0°С. Концентрация соли NaCl в растворе от 0,1 до 26,3 %. По данным таблицы видно, что с повышением концентрации соли в растворе, его теплоемкость снижается.
Теплофизические свойства раствора NaCl
В таблице представлены теплофизические свойства раствора хлористого натрия NaCl в зависимости от температуры и концентрации соли. Концентрация хлорида натрия NaCl в растворе от 7 до 23,1 %. Необходимо отметить, что при охлаждении водного раствора хлорида натрия его удельная теплоемкость меняется слабо, теплопроводность снижается, а значение вязкости раствора увеличивается.
Даны следующие теплофизические свойства раствора NaCl:
- плотность раствора, кг/м 3 ;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость раствора, Па·с;
- кинематическая вязкость раствора, м 2 /с;
- коэффициент температуропроводности, м 2 /с;
- число Прандтля.
Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
В таблице представлены значения плотности растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации. Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре раствора 15°С. Концентрация хлорида кальция CaCl2 в растворе находится в диапазоне от 0,1 до 37,3 % при его температуре 15°С. Плотность растворов хлорида натрия и кальция растет при увеличении содержания в нем соли.
Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
В таблице даны значения среднего коэффициента объемного расширения водных растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации и температуры.
Коэффициент объемного расширения раствора соли NaCl указан при температуре от -20 до 20°С.
Коэффициент объемного расширения раствора хлорида CaCl2 представлен при температуре от -30 до 20°С.
- Чубик И. А., Маслов А. М. Справочник по теплофизическим характеристикам пищевых продуктов и полуфабрикатов.
- Данилова Г. Н. и др. Сборник задач по процессам теплообмена в пищевой и холодильной промышленности. М.: Пищевая промышленность, 1976.- 240 с.
Источник
Натрий. Вред и польза соли.

Хлор также является необходимым элементом. Участвует в образовании соляной кислоты желудочного сока. Если не хватает хлора — начинаются сбои в работе кишечника и переваривании пищи.
Современный человек в среднем съедает 5 кг соли в год вместо 1,8 кг по норме.
Соль присутствует в рационе каждого человека. Большинство из нас щедро солит еду, не задумываясь, полезно это или нет, потому что соль — как вода, как хлеб, как картошка, мы привыкли к ней. Соль, по нашему мнению, делает еду вкуснее. Сколько соли можно есть в день? Всемирная организация здравоохранения рекомендует употреблять до 5 г соли в сутки. Это примерно одна чайная ложка. Однако, в результате исследований выяснили, что большинство людей употребляет 9–12 и более грамм. Проблема в том, что многие люди не знают, сколько соли употребляют. Основное количество натрия все получают с продуктами промышленного производства.
Признаки, что вы едите много соли: повышенное давление, частое мочеиспускание, жажда, отёки. При этих признаках каждому человеку необходимо задуматься. Возможно, всего лишь ограничение хлорида натрия поможет избавиться от таких проблем. Повышенное содержание соли зарегистрировано в следующих продуктах: фастфуд; хлеб, вся выпечка; консервированные овощи; супы; колбасные изделия; мясные и рыбные консервы; солёные сыры; чипсы и сухарики; различные соусы и приправы. Эти категории не соответствуют принципам рационального и сбалансированного питания, поэтому желательно их ограничивать всем. Жидкость, которая содержится в клетках нашего организма и межклеточном пространстве, -тоже соленая. И важно, чтобы концентрация соли, микроэлементов, поддерживалась на одном уровне.
Избыток натрия в крови:
— провоцирует нарушение водного баланса, задержку жидкости и, как следствие, отеки -как видимые, так и скрытые, осложняющие работу внутренних органов;
— повышает кровяное давление, что может привести к инфаркту, инсульту и прочим сердечно-сосудистым заболеваниям, а также остеопорозу, глаукоме, катаракте, ожирению и даже раку желудка;
— нарушает баланс микроэлементов, избыток натрия снижает содержание в организме калия, кальция, магния, фосфора, железа, а это увеличивает нагрузку на сердце, почки, может привести к самым разным болезням. Примерно одна треть взрослого населения планеты имеет высокое кровяное давление (гипертония). У многих, из остальных наблюдается «предгипертензия», это означает, что у них еще нет высокого кровяного давления, но болезнь на стадии развития, и обязательно разовьется, если не принимать меры. Так как, доказано, что кровяное давление напрямую связано с потреблением пищи с солью (натрий), нужно внимательней относиться к тому, что вы едите.
Как уменьшить потребление соли:
— ограничить употребление солёных закусок, консервированных овощей, приправ (соевый соус, глутамат натрия, бульонные кубики);
— недосаливать блюда и вообще не ставить на стол солёные соусы и солонку;
— выбирать продукты с низким содержанием натрия, для этого читайте состав, ищите информацию на этикетках.
Как вывести лишнюю соль из организма:
— пейте больше чистой воды — она эффективнее всего выводит лишнюю соль, при этом рекомендуется пить воду небольшими порциями, по несколько глотков в течение всего дня, используйте свежевыжатые, натуральны соки, кислое молоко, включайте в рацион зеленые овощи (лук, свеклу, спаржу, некоторые лечебные травы, имеющие мочегонный эффект);
— не забывайте про физические нагрузки, которые помогают вывести лишнюю жидкость и соль из организма, пейте воду во время занятий, чтобы компенсировать ее потерю и избежать обезвоживания организма;
Вместе с солью из организма выводятся и другие микроэлементы, поэтому старайтесь увеличить в рационе количество полезных продуктов, богатых калием, который укрепляет сердечно-сосудистую систему.
Нет нужды резко менять пищевые привычки и ломать себя. Все нужно делать постепенно.
Источник
Температурная депрессия раствора хлорида натрия
Минская областная клиническая больница
Инфузионная терапия является наиболее часто используемым видом лечения в отделении анестезиологии и реанимации. Как все лекарственные препараты, инфузионные растворы имеют побочные эффекты и их использование связано с определенным риском.
Традиционно в качестве базового раствора при проведении заместительной, поддерживающей, возмещающей терапии используется физиологический раствор (normalsaline). Инфузионная терапия физиологическим раствором часто проводится в объемах, превышающих необходимые со скоростями, более чем достаточными. В литре физиологического раствора содержится 154 ммоль натрия и столько же ммоль хлора. Количество хлоридов, равное 154 ммоль/л, в полтора раза превышает норму для плазмы, что часто заставляет врачей использовать другие растворы. Без достаточных знаний в области инфузионной терапии выбор врача чаще всего падает на раствор Рингера. Действительно, основным инфузионным раствором в республике Беларусь, способным конкурировать с 0.9% р-ром натрия, является раствор Рингера. Так ли это на самом деле и существуют ли более достойные альтернативы физиологическому раствору?
Альтернативный физиологическому раствору раствор Рингера был придуман профессором Сиднеем Рингером в 1880-ых после наблюдения за изолированным сердцем лягушки. Профессор Рингер заметил, что солевой раствор, приготовленный на основе дистиллированной воды, обладает худшей эффективностью в поддержании сократимости сердца лягушки по сравнению с раствором, приготовленным на основе воды из крана. Было выяснено, что в водопроводной воде содержатся примеси солей кальция и калия[18]. Данное наблюдение позволило предположить, что добавление вышеуказанных ионов в раствор играет важную роль в поддержании нормальной функции сердца. К слову, данный факт не является научно подтвержденным in vivo, однако является родоначальником множества догм и парадигм. Так, потребности в калии могут сильно варьировать, что часто требует отдельного назначения необходимой дозы препаратов калия, а добавки кальция и магния большей частью усложняют подбор совместимости различных препаратов в одной инфузионной линии, имея выраженную тенденцию к преципитации, особенно в растворах, содержащих CO2 (бикарбонат натрия). Гипокальциемический порог для развития коагулопатии составляет + , мэкв/л
* — Здесь препарат представлен в виде дигидрата кальция: CaCl2 × 2H2O, в других – в виде гексагидрата кальция: CaCl2 × 6H2O.
† — Теоретическая осмолярность получается путем сложения всех осмотически активных веществ в растворе на 1 литр раствора. Осмоляльность – количество всех осмотически активных веществ на 1 кг растворителя. Физиологическая осмоляльность всех жидкостей организма, включая плазму, составляет 286±5 ммоль/кг H2O. Теоретическая осмолярность организма составляет 291 мосм/л.0,9% раствор натрия хлорида имеет теоретическую осмолярность 308 ммоль/л и осмотический коэффициент 0,926 (только 93% NaCl осмотически активно); следовательно, его физиологическая (измеренная) осмоляльность составляет 286 ммоль/кг H2O
Итак, отечественные аналоги раствора Рингера представлены двумя видами, содержание хлоридов в которых и их осмолярность превышают таковые показатели в 0,9% растворе NaCl. Оригинальный раствор Рингера, как видно, имеет более низкую концентрацию натрия. Таким образом, выпускаемый отечественный раствор Рингера является 0,9% раствором хлорида натрия с добавками хлорида кальция и хлорида калия, что и объясняет высокую итоговую концентрацию хлоридов.
Разница сильных ионов
Для объяснения физиологического эффекта инфузии несбалансированных растворов используют модель поведения кислот и щелочей канадского физиолога Питера Стюарта. Для описания КЩС Стюарт использовал серию уравнений, учитывающих закон действующих масс (Гульдберга и Вааге), закон сохранения масс и закон электронейтральности применимо к водным растворам.
При оценке кислотно-щелочного состояния согласно Стюарту выделают так называемое «рабочее» пространство КЩС: интерстиций, плазма и эритроциты (IPE – Interstitium, Plasma and Erythrocytes). Любое итоговое равновесие системы является функцией трех независимых переменных, находящихся в IPE. Эти переменные включают в себя pCO2 (парциальное давление углекислого газа в растворе), SID (разница сильных ионов в растворе — strong ion difference) и A[TOT] (общая концентрация слабых кислот в растворе – альбумин, фосфаты) [19].
SID является разницей между зарядом полностью диссоциируемых катионов (натрий, калий, кальций, магний) и анионов (хлориды, лактат, кетоновые кислоты и другие органические кислоты с pKa + + K + + Ca ++ + Mg ++ ) – Cl — + (другие сильные анионы)
Если допустить, что в растворе присутствуют только основные заряженные частицы, то, согласно закону электронейтральности, SID должен быть равным нулю. В биологических жидкостях SID не равен нулю, а представляет собой положительный заряд. Это объясняется присутствием в биологических растворах слабых электролитов, например, белков и фосфатов [1]. Следовательно, заряд сильных катионов превышает заряд сильных анионов и разница в норме составляет порядка 40 мэкв/л. Увеличение SID ведет к алкалозу (в основном за счет увеличение количества HCO3 — ), уменьшение SID ведет к ацидозу (за счет снижения количества HCO3 — ). Напротив, увеличение A[TOT] ведет к ацидозу, уменьшение – к алкалозу.
Согласно теории Стюарта, любые изменения среды организма под действием инфузионных растворов обусловлены изменением SID и A[TOT]. У всех кристаллоидных растворов A[TOT] = 0, поэтому их введение вызывает снижение внеклеточной A[TOT] вследствие простой дилюции альбумина и фосфатов плазмы, в то время как значения SID плазмы будут меняться в сторону значений SID инфузируемого раствора.
Так, SID физиологического раствора NaCl равен нулю (равные концентрации Na + и Cl — ). При введении 0,9% NaCl в больших объемахи за короткий временной промежуток (например, 4 л за 2 часа) происходит два одновременных процесса: снижение SID (метаболический ацидоз) и снижение A[TOT] (метаболический алкалоз). Если у пациента нет предшествующих расстройств КЩС, то в итоге всегда развивается метаболический ацидоз. Если у пациента уже имеется почечный канальцевый или гиперхлоремический ацидоз вследствие потерь кишечного содержимого, инфузия изотонического NaCl может существенно усугубить состояние. Не следует забывать, что гипотонический раствор NaCl также имеет нулевой SID. Нулевой SID имеют даже растворы, не содержащие в своем составе сильные ионы, такие как глюкоза, маннитол и вода. Инфузия таких растворов снижает внеклеточный SID аналогичными механизмами и независимо от уровня хлоридов сдвигает кислотно-щелочной баланс в сторону ацидоза. Следует отдельно отметить, что практически все имеющиеся на рынке коллоидные растворы тоже основаны на 0,9% NaCl.
Если растворы с низкой концентрацией хлоридов вызывают метаболический ацидоз из-за снижения SID, то может даже наблюдаться снижение уровня хлоридов плазмы. Снижение SID в таких случаях будет обусловлено непропорционально бо́льшим снижением уровня натрия плазмы.
Использование растворов со слишком высоким SID может вызвать алкалоз передозировки, который может быть нежелательным при нарушенной доставке кислорода, например, в шоковых состояниях [20, 10].
Эффект гиперхлоремии
Несколько литров 0,9% р-ра натрия хлорида, введенного внутривенно в течение нескольких часов, достоверно вызывает гиперхлоремию, связанную с метаболическим ацидозом с нормальной анионной разницей. С одной стороны, дефицит оснований практически никогда не падает ниже -10 мэкв/л даже при назначении больших объемов инфузии (50 мл/кг в течение 2 часов), а pH редко достигает значений — = 154 ммоль/л) течение 1 часа в сравнении со сбалансированным раствором «Plasma-Lyte-148» (Cl — =98 ммоль/л) вызывала в последующем удлинение времени до первого мочеиспускания с 90 до 142 минут (p = 0.006), снижение объема мочи с 833 мл до 523 мл (р = 0,002), а также значительное снижение почечного артериального кровотока и кортикальной перфузии почек по данным МРТ [6]. Данный эффект, по всей видимости, обусловлен действием хлоридов на macula densa: повышением тонуса афферентной артериолы, а также компрессией почечных кортикальных сосудов под действием повышенного внутрикапсульного давления [33, 13]. Изменения гемодинамики в клубочках, перераспределение почечного кровотока, микроциркуляторная дисфункция и системный воспалительный ответ в совокупности приводят к нарушению функции почек даже при сохраненном или увеличенном почечном кровотоке.
Так, у пациентов, которым проводилась экстренные абдоминальные операции, использование 0,9% NaCl привело к увеличению летальности (5.6% против 2.9% при использовании сбалансированных растворов, P — на менее сильный анион: OH — , HCO3 — или CO3 2- , или на быстро метаболизирующийся анион. Использование ОН — приводит к образованию сильного щелочного раствора (pH = 12.4 при 25 °С), а использование CO3 2- увеличивает риск преципитации кальция. Основной проблемой при производстве бикарбонат-содержащих растворов является техническая: для предотвращения диссоциации до CO3 2- необходимо поддерживать высокое давление CO2 (pCO2) в растворе на всех этапах производства.
Для предотвращения диффузии рCO2в окружающую среду необходимо использовать непроницаемые материалы – например, стеклянные флаконы. Для ингибирования преципитации при появлении небольших количеств CO3 2- в раствор добавляют небольшое количество цитрата или L-лактата.
Лактат
Лактат, используемый в растворах, изначально представлял собой рацемическую смесь. В настоящее время используют L-лактат. Лактат является промежуточным звеном метаболизма глюкозы, элементом цикла Кори. В процессе основного обмена организм производит примерно 1 ммоль лактата на кг массы тела в час [14,34]. Максимальная же скорость утилизации лактата в эксперименте может достигать 450 ммоль/час [8]. Назначение L-лактата в количестве до 100 ммоль/час (около 4 литров раствора Рингера-лактата в час) не вызывает увеличения лактата плазмы при отсутствии тяжелых нарушений функции печени. Поскольку до 70% экзогенного лактата подвергается глюконеогенезу после превращения в пируват (часть цикла Кори), то может возникнуть нарушение гомеостаза глюкозы, особенно среди пациентов с сахарным диабетом, с двукратным повышением глюкозы крови [2]. Остальные 30% лактата поступают в цикл Кребса после превращение в ацетил-КоА с последующим образованием CO2. При накоплении L-лактата гликолиз замедляется на стадии глицеральдегид-3-фосфатдегидрогеназы, что снижает наработку АТФ. Более того, на метаболизм каждого моля лактата расходуется 3 моля O2:
Как следствие, после болюса 330 ммоль лактата у здоровых добровольцев происходило увеличение потребления O2 почти на 30% [29].
При накоплении экзогенного лактата в крови лактат теряет прогностическую ценность как маркер плохого исхода у пациентов с септическим или иным шоком. Как правило, при уровнях эндогенного лактата плазмы 4-7 ммоль/л в первые 24-48 часов шока летальность составляет 50%.
Оригинальный Рингер-лактат является слегка гипотоничным раствором. Введение Рингера-лактата в дозе 50 мл/кг в течение часа у здоровых волонтеров снижало осмолярность плазмы на 4 мосм/кг [31]. В экспериментах на животных равноценное снижение тоничности увеличивает внутричерепное давление более 5 mmHg.
Ацетат
Ацетат обладает более быстрым метаболизмом чем лактат, скорость утилизации ацетата достигает 300-350 ммоль/час. Ацетат не вызывает значимой гипергликемии и требует меньше кислорода для утилизации. Метаболизм ацетата связан с высвобождением бикарбоната в эквимолярных количествах:
На один моль ацетата расходуется два моля O2, но вырабатывается только один моль CO2 (дыхательный коэффициент 0,5). Ацетат сам по себе является незначительным источником энергии, поставляя 209 ккал/моль. От 60 до 80% ацетата элиминируется в виде CO2 через легкие.
Ацетат метаболизируется преимущественно в мышцах, что вызывает его меньшее накопление при шоке и печеночной дисфункции. Высокие концентрации ацетата в плазме вызывают гипотензию, прямой кардиодепрессивный эффект и сложные метаболические расстройства [21], что в основном имеет место при использовании ацетат-содержащих диализных растворов. Использование ацетата при жидкостной ресусцитации не показывает признаков токсичности.
Глюконат
Метаболизм глюконата самый медленный, однако протекает без токсичных эффектов. Более того, концентрация глюконата 2,4 ммоль/л и 4,8 ммоль/л показала защитный эффект при постишемической дисфункции миокарда и в уменьшении окислительного повреждения [25]. Использование глюконата может вызвать ложно-положительные тесты при определении галактоманнана (биомаркера инвазивного аспергиллёза). На один моль глюконата расходуется 5,5 моль O2, что ограничивает его использование в интенсивной терапии.
Другие анионы
В качестве резервных анионов могут также использоваться цитрат, малат и сукцинат – элементы цикла Кребса. Цитрат является компонентом препаратов крови и необходим для хелатирования кальция и предотвращения свертываемости. По этой причине цитрат практически не используют в инфузионной терапии. При окислении 1 моля цитрата производится 3 моль бикарбоната. 1 моль малата при окислении дает 2 моля бикарбоната. Сукцинат и малат используются в растворах, как правило, в небольших количествах, поскольку их метаболизм ограничен мощностью цикла Кребса.
Существуют и иные потенциальные заменители бикарбоната – пируват, D-β-гидроксибутират, транс-каротиноиды. Пируват метаболизируется до токсических продуктов и слишком нестабилен в растворе. Существует раствор, содержащий предшественник пирувата – енолат (раствор «Рингер Этил-Пируват»), а также вариант раствора с кетоновыми телами: “Ringerketone”. D-β-гидроксибутират описан как «супертопливо» для нейронов, стабилен при комнатной температуре, не нуждается в инсулине, быстро метаболизируется и в высоких концентрациях показывает нейропротекторные свойства [3, 30, 32].
Лекарственная несовместимость
Противопоказано использовать инфузионные растворы, содержащие кальций одновременно с цефтриаксоном у новорожденных (до 28 дней) даже при введении в отдельные линии вследствие риска фатальной преципитации солей цефтриаксона-кальция в крови новорожденного. Пациентам старше 28 дней (включая взрослых) цефтриаксон не должен назначаться одновременно с содержащими кальций растворами (раствор Рингера, Рингера-Лактата) через одну линию. Нельзя одновременно назначать препараты крови, содержащие цитрат, с кальций-содержащими растворами из-за риска тромбообразования. Растворы с добавкой глюкозы должны назначаться с осторожностью пациентам с аллергией на зерновые продукты. Необходимо соблюдать осторожность при назначении растворов Рингера-Лактата пациентам, принимающим препараты, чей почечный клиренс зависит от pH. Так, использование Рингера-Лактата увеличивает клиренс лекарств-кислот (салицилаты, барбитураты) и уменьшает клиренс щелочных лекарств (эфедрин, псевдоэфедрин, хинидин, декстроамфетамина сульфат) за счет итогового подщелачивающего действия и его влияния на степень ионизаци молекул.
Идеальный раствор
Идеальный инфузионный раствор должен не оказывать негативного эффекта на прогноз заболевания, обладать удовлетворительной фармакокинетикой, не накапливаться в тканях, не оказывать эффекта на электролитный состав плазмы, КЩС, не обладать отрицательными эффектами на гемостаз и иммунную систему, должен быть дешевым, легко храниться и иметь длительный срок годности. Следует сразу отметить, что на текущий момент не существует ни одного инфузионного раствора, удовлетворяющего данным требованиям.
Какой же раствор может претендовать на «место под солнцем» в интенсивной терапии и анестезиологии? Понятно, что это должен быть изотоничный раствор с количеством хлоридов меньше, чем в 0,9% NaCl. Остается выбрать оптимальный анион, способный заменить хлориды в растворе. Учитывая сложность производства бикарбонат-содержащих растворов и технические сложности, связанные с его хранением, вместо бикарбоната выгоднее использовать лактат. Общая концентрация катионов в таком растворе должна составлять 154 ммоль/л. Учитывая вышеизложенное, добавлять калий в раствор не рекомендуется. Количество хлоридов должно составлять 130 ммоль/л, таким образом, SID раствора будет равна 24 мэкв/л.
Na +
154
24
130
Рис. 1. Схема ионного состава идеального раствора. A — — количество дополнительного аниона. Цифры представлены в мэкв/л.
Попробуем определить, какой из растворов, имеющихся на рынке, максимально соответствует данным требованиям.
Итак, существующие на отечественном рынке сбалансированные инфузионные растворы представлены в основном следующими препаратами: (Табл. 2).
Таблица 2. Качественный состав многокомпонентых инфузионных растворов.
| Рингер-Лактат Baxter | Рингер-лактат, Фармлэнд | Лактасол, Фармлэнд | Дисоль, НЗМП | Ацесоль, НЗМП | Трисоль, НЗМП | Хлосоль, НЗМП | Квинтасоль РУП Белмедпрепараты | Ионоацетат, НЗМП | |
| Na + , мэкв/л | 130 | 131,6 | 136 | 126 | 110 | 133 | 125 | 120 | 137 |
| Cl — , мэкв/л | 109 | 112,5 | 115 | 102 | 99 | 99 | 101 | 99 | 110 |
| K + , мэкв/л | 4 | 5 | 4 | — | 13 | 13 | 20 | 5,0 | 4 |
| Ca 2+ , мэкв/л | 2.7 | 4,9 | 2,9 | — | — | — | — | 2,6 | 3,3 |
| Mg 2+ , мэкв/л | — | — | 2 | — | — | — | — | 1,4 | 2,5 |
| Лактат,мэкв/л | 28 | 29 | 29,9 | — | — | — | — | — | — |
| Ацетат,мэкв/л | — | — | — | 24 | 24 | — | 44 | 30 | 36.8* |
| HCO3 — , мэкв/л | — | — | — | — | — | 47 | — | — | — |
| SID эффект., мэкв/л | 26 † | 27 | 27,9 | 24 | 24 | 47 | 44 | 30 | 36.8 |
| Осмолярность, теор., мосм/л | 273 | 278 | 285 | 252 | 246 | 292 | 290 | 254 | 287,8 |
*некоторые значения округлены.
† допуская, что лактат плазмы равен 2 мэкв/л.
Растворы с высоким SID – «Трисоль», «Хлосоль», «Квинтасоль», «Ионоацетат» приводят к метаболическому алкалозу и показаны при коррекции метаболического ацидоза (например, регидратация при тяжелой диарее). Среди имеющихся на рынке сбалансированных растворов отечественного производства в качестве идеального базового раствора больше всего подходит раствор Рингер-Лактат и Лактасол (ООО «ФармЛэнд»). SID Рингера-Лактата равна 27 мэкв/л, а Лактосола – 27,9 мэкв/л, что выше идеального SID. При больших объемах инфузий Рингера-лактата и Лактосола может развиться алкалоз «перебора» — результат разведения слабых кислот и избыточной наработки бикарбоната после метаболизма лактата.
Выводы
Разница в количестве хлоридов и SID между кристаллоидными инфузионными средами является клинически значимой и оптимальный SID для проведения инфузионной терапии составляет 24 мэкв/л. Физиологический раствор представляет собой нефизиологичный раствор с повышенным содержании хлоридов и SID = 0. Используемый как альтернатива раствор Рингера содержит дополнительные соли калия и кальция, чье значение в клинической практике пока не определено, а также еще большее количество хлоридов, что ограничивает его роль в интенсивной терапии. Среди имеющихся сбалансированных растворов оптимальными с фармакоэкономической точки зрения являются лактат-содержащие растворы (Рингер-Лактат, Лактосол). Базовый инфузионный раствор, удовлетворяющий современным требованиям, должен содержать SID = 24 мэкв/л, быть дешевым, простым в производстве и хранении и обладать минимальными метаболическими эффектами. На текущий момент подобного раствора не существует, но есть явная клиническая необходимость его создания.
Благодарность: автор выражает благодарность ООО «ФармЛэнд» за предоставленную техническую информацию.
Финансовая поддержка и спонсорство: отсутствуют
Конфликт интересов: отсутствует
Источник