Механизмы стресса
1. Стресс-реализующие системы. В нормальном здоровом организме человека существуют механизмы, направленные на борьбу с неблагоприятными факторами, воздействие которых может привести к гибели. Следует подчеркнуть, что данные механизмы приспособления к воздействию стрессоров неспецифичны и являются общими для любых стрессовых воздействий, что позволяет говорить об общем адаптационном синдроме (или стресс-реакции). Нелегко представить себе, что холод, жара, лекарства, гормоны, печаль и радость вызывают одинаковые биохимические сдвиги в организме. Однако дело обстоит именно так. Количественные биохимические измерения показывают, что некоторые реакции неспецифичны и одинаковы для всех видов воздействий.
При рождении ребенка женщина испытывает физическую боль, она напугана незнакомой обстановкой, она тревожится за жизнь и здоровье ребенка, одним словом, испытывает сильное душевное и физическое потрясение. Спустя некоторое время, она впервые берет на руки своего малыша, чувствует прилив нежности и сильнейшую радость. Специфические результаты двух событий — родов и долгожданного рождения — совершенно различны, даже противоположны, но их стрес-сорное действие — неспецифическое требование приспособления к новой ситуации — может быть одинаковым.
В современной литературе механизмы, лежащие в основе стресс-реакции, называют стресс-реализующими системами.
Первый этап в стресс-реакции — активация симпатического и парасимпатического звеньев автономной нервной системы. Сильное эмоциональное возбуждение вызывает активацию высших вегетативных центров, в том числе эрготрофных (симпатических, в основном задних ядер гипоталамуса), и активацию симпатической нервной системы, что в свою очередь повышает функциональные возможности скелетных мышц, сердечно-сосудистой и дыхательной систем. Одновременно с этим увеличивается активность трофотропных (парасимпатических) ядер гипоталамуса и парасимпатического отдела автономной нервной системы, что обеспечивает высокие возможности восстановительных процессов, направленных на сохранение гомеостаза (постоянства внутренней среды) в организме. Физиологические изменения в организме, наблюдаемые на первом этапе стресс-реакции:
усиление сердечных сокращений;
расширение сосудов сердца;
сужение брюшных артерий;
расширение бронхиальных трубок;
увеличение силы скелетных мышц;
выработка глюкозы в печени;
увеличение продуктивности мыслительной деятельности;
расширение артерий, проходящих в толще скелетных мышц;
ускорение обмена веществ.
Если стрессор продолжает действовать, то возможности симпатической нервной системы по причине ограниченности запасов медиаторов (биологически активных веществ, секретируемых нервными окончаниями и обусловливающих передачу нервных импульсов) не позволяют противодействовать ему. В этом случае включается следующий, второй, механизм, который получил название реакции «битва—бегство» (позволяет организму либо бороться с угрозой, либо бежать от нее). Данная реакция рассматривается как мобилизация организма, подготавливающая мышцы к активности в ответ на действие стрессора.
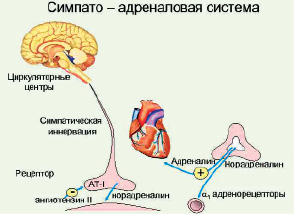
При возбуждении миндалевидного ядра (одного из центральных образований лимбической системы) мощный поток импульсов идет к эрготропным ядрам гипоталамуса, оттуда импульсация направляется к грудному отделу спинного мозга и, наконец, к центральному органу этого механизма — мозговому слою надпочечников. В результате происходит выброс адреналина и норадреналина, что приводит к увеличению артериального давления, сердечного выброса, снижению кровотока в неработающих мышцах и органах, возрастает уровень свободных жирных кислот, триглицеридов, холестерина и глюкозы.
Благодаря этим физиологическим изменениям люди в чрезвычайной ситуации способны совершать невероятные поступки. Когда достаточно слабый человек поднимает машину, которой придавило ребенка, можно говорить о невероятной силе, сообщаемой нам реакцией «битва—бегство». Важно отметить, что функцией парасимпатической нервной системы является возвращение нас в расслабленное состояние после того, как угроза миновала.
В целом первый и второй механизмы общего адаптационного синдрома называют симпато-адреналовой реакцией (САР). Если стрессор продолжает оказывать повреждающее воздействие, не компенсируемое реакцией «битва—бегство», то наступает следующий этап в стресс-реакции, в ходе которого активизируются другие эндокринные механизмы — адренокортикальный, сома-тотропный и тиреоидный.
Адренокортикальный механизм включается в том случае, если активация симпатической нервной системы и мозгового слоя надпочечников оказывается неэффективной. Цепь событий в этом случае такова: неокортекс —> септально-гипоталамический комплекс —> выделение кортиколиберина —> активация гипофиза —> выработка АКТГ —> активация коры надпочечников —> выделение глюкокортикоидов (кортизол, гидрокортизон и др.) и ми-нералкортикоидов (альдостерон).
Главное в этом механизме — это продукция глюкокортикоидов, поскольку они вызывают значительное повышение энергетических запасов (возрастает уровень глюкозы и свободных жирных кислот). Все это происходит для того, чтобы подготовить организм для дальнейшей борьбы со стрессом или бегству от него. Однако чрезмерное выделение глюкокортикоидов приводит к нежелательным эффектам, то есть наступает плата за адаптацию. Одним из наиболее важных изменений является снижение лимфоцитов (вырабатываются вилочковой железой и лимфатическими узлами), которые крайне важны для нормальной деятельности иммунной системы, так как их основная функция — уничтожение инородных субстанций (например, бактерий). Вследствие этого резко снижается интенсивность иммунных механизмов. Одновременно на данном этапе возрастает риск развития инфаркта миокарда за счет спазма сосудов.
Альдостерон также подготавливает нас к активным действиям, поднимая артериальное давление настолько, чтобы питательные вещества и кислород быстрее и легче поступали к наиболее активным частям нашего организма — внутренним органам и конечностям. Повышение артериального давления происходит за счет увеличения объема жидкостей в организме вследствие снижения выработки мочи и задержки выработки натрия.
Многие авторы считают, что одновременно с адренокор-тикальным активируется соматотропный механизм: нео-кортекс—> септально-гиппокампово-гипоталамическое возбуждение —> выделение соматолиберина гипоталамусом —> выделение соматотропного гормона аденогипофи-зом. Данный гормон (за счет высвобождения соматомеди-на) повышает резистентность к инсулину (как при диабете), ускоряет мобилизацию накопленных в организме жиров, в результате чего в крови повышается содержание глюкозы и свободных жирных кислот, то есть увеличиваются энергетические запасы.
Активация тиреоидного механизма происходит по следующей схеме: неокортекс —> септально-гиппокампово-гипоталамическое возбуждение —> тиролиберин гипоталамуса —> активация гипофиза —> выработка тириотропного гормона (ТТГ) —> активация щитовидной железы —> выработка тиреоидных гормонов (ТЗ — трийодтиронин, Т4 — тироксин). Физиологический смысл данного защитного механизма заключается в том, что тиреоидные гормоны повышают чувствительность тканей к циркулирующим в крови катехоламинам, повышают уровень энергообразования, активизируют деятельность сердца (сократимость, ЧСС), повышают артериальное давление, в целом учащается базальный ритм метаболизма. При этом повышается тревожность и уменьшается чувство усталости.
В настоящее время многими учеными проводятся исследования на тему «Может ли стресс стать причиной необратимых нарушений мозга». Гиппокамп — это та часть мозга, которая «бьет тревогу» при столкновении со стрессом. Именно рецепторы клеток гиппокампа определяют присутствие в организме глюкокортикоидов, вырабатываемых надпочечниками (уже в течение первых 30 минут в слюне диагностируется повышение уровня кортизола). Продолжительный стресс разрушает эти рецепторы и клетки гиппокампа в целом. А поскольку клетки мозга лишены способности восстанавливаться, то мы теряем их навсегда. Отсюда возникает очень интересный вопрос: возможно, если у нас станет недостаточно глюкокортикоид-ных рецепторов, мы перестанем реагировать на стресс? Для ответа на этот вопрос ученые продолжают проводить эксперименты.
2. Стресс-лимитирующие системы. В процессе эволюции в организме человека появились механизмы, которые препятствуют развитию стресс-реакции или снижают ее побочные отрицательные воздействия на органы-мишени. Такие механизмы получили название стресс-лимитирующие системы, или системы естественной профилактики стресса.
ГАМК-эргическая система. Гамма-аминомасляная кислота (ГАМК) продуцируется многими нейронами ЦНС, в том числе и тормозными. Под влиянием ферментов ГАМК превращается в мозге в ГОМК (гамма-оксимасляная кислота), которая способна тормозить деятельность многих структур мозга, в том числе и гипоталамуса. В результате не происходит запуска стресс-реакции.
Эндогенные опиаты (энкефалины, эндорфины, динорфины). Образуются из бета-липотропина в гипофизе под влиянием стресса. Эти вещества вызывают эйфорию, снижают болевую чувствительность, повышают работоспособность, увеличивают возможность выполнения длительной мышечной работы, снижают чувство тревоги. В целом эти вещества снижают психогенные реакции человека на раздражители, уменьшая интенсивность эмоциональной реакции, запускающей стресс-реакцию.
Простогландины (преимущественно группы Е). Их продукция возрастает при стрессе, в результате чего снижается чувствительность ряда тканей к действию ка-техоламинов. Особенно это выражается в отношении чувствительности нейронов центральной нервной системы к норадреналину. Таким образом, простогландины снижают выраженность стресс-реакции.
Антиоксидантная система. Как отмечалось ранее, при действии глюкокортикоидов активируется перекисное окисление липидов, следствием чего является образование свободных радикалов, которые приводят к активации многих биохимических реакций в клетках, что нарушает их жизнедеятельность (плата за адаптацию). Однако в организме существуют эндогенные «тушители» этих сво-боднорадикальных процессов, которые получили название антиоксиданты. К ним относят витамин Е, серосодержащие аминокислоты (цистин, цистеин), фермент суперок-сиддисмутаза.
Трофотропные механизмы. Активация парасимпатической нервной системы во время стресс-реакции представляет собой важнейший механизм зашиты от побочных эффектов глюкокортикоидов и других участников стресс-реакции.
Следует отметить, что помимо запуска этого защитного механизма естественным путем (неокортекс —> гипоталамус —> парасимпатические центры ствола мозга и сакрального отдела спинного мозга), существует возможность искусственного повышения активности парасимпатического отдела автономной нервной системы, что можно использовать в качестве профилактики негативных последствий стресса. Тонус парасимпатической нервной системы повышается при умеренной физической нагрузке, мышечной релаксации или медитации. Медитация представляет собой различные формы сосредоточения — повторение отдельных слов или фраз («мантр»), повторение физических действий, например, дыхательные движения с концентрацией внимания на них, зрительная концентрация, сосредоточение на какой-то парадоксальной проблеме (например: как звучит хлопок одной ладони?). К повышению активности парасимпатического отдела ВНС приводит переход на диафрагмальное дыхание. Реберное и ключичное дыхание активизирует симпатическую нервную систему.
Сбалансированная работа симпатического и парасимпатического отделов автономной нервной системы позволяет человеку адекватно реагировать на любые предъявляемые требования. В организме человека существуют естественные механизмы, активизирующиеся при воздействии стрессогенных факторов и направленные на борьбу со стрессом, а также системы, препятствующие развитию стресс-реакции или снижающие ее побочные отрицательные воздействия.
Вопросы к главе 3:
1. Чем представлены центральный и периферический отделы нервной системы?
2. Из каких отделов состоит головной мозг человека?
Какие функции выполняют соматическая и автономная (вегетативная) нервная система?
Чем отличаются по своему воздействию на организм симпатический и парасимпатический отделы автономной нервной системы?
Дайте определение понятию «стресс-реализующие системы».
Какова физиологическая роль выброса в кровь гормонов адреналина и норадреналина на начальных этапах стресс-реакции?
К каким нежелательным эффектам приводит чрезмерное выделение глюкокортикоидов при включении в стресс-реакцию адренокортикального механизма?
Какие стресс-лимитирующие системы, существующие в организме человека, вам известны?
Как в рамках профилактики негативных последствий стресса можно искусственно повысить активность парасимпатического отдела автономной нервной системы?
При возникновении стрессовой ситуации в организме резко увеличивается выработка глюкозы в печени. Объясните физиологический смысл этого явления.
Источник
Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
3. Стресс и симпато-адреналовая система
Многочисленными исследованиями установлено, что роль пускового фактора во многих реакциях организма, в ответ на действие разнообразных агентов, играют гормоны мозгового вещества надпочечников, выполняющие одновременно роль медиаторов симпато-адреналовой системы. Экстренное выделение катехоламинов при действии внешних стимулов есть первое проявление стресса.
Согласно представлениям И.П. Павлова, реакция организма на чрезвычайное разражение и возникающие при этом повреждения органов, являются результатом нарушения трофики, вызываемых чрезмерной нервной импульсацией. На основании многочисленных исследований Л.А. Орбели построил теорию об адаптационно-трофической функции симпатической нервной системы. «С одной стороны, она (симпатическая нервная система) изменяет функциональные свойства, адаптация, с другой – вызывает существенные химические, физико-химические и физические сдвиги (трофики)» – Л.А. Орбели (1962).
Рис. 8. Симпато-адреналовая система
Целым рядом исследований показано, что возбуждение симпато-адреналовой системы, сопровождаемое мобилизацией катехоламинов, является одной из ранних реакций организма на лучевое воздействие и свидетельствует о пусковой роли гормонов мозгового вещества в реакциях адаптации (В.С. Даниленко и др., 1970, Г.М. Мусагалиева и др., 1988).
Известно (А.М. Бару, 1968,), что увеличение или уменьшение коэффициента А/НА отражает степень активности периферического, либо центрального отдела симпато-адреналовой системы (САС). Установлено, что стресс может привести к нарушениям механизмов адаптационных реакций, к истощению медиаторного звена симпато-адреналовой системы.
Наблюдаемая при стрессе активация симпато-адреналовой системы носит компенсаторный характер и происходит за счет гуморального звена. Повышенная экскреция катехоламинов при стрессе также указывает на значительную активацию симпато-адреналовой системы.
Активация симпато-адреналовой системы при хирургическом стрессе вызывает нарушения гемодинамики, особенно эти нарушения выражены у больных с облитерирующими заболеваниями сосудов, у которых отмечаются снижение сердечного и ударного индексов, повышение общего периферического сопротивления сосудов.
Вместе с тем, активация симпато-адреналовой системы с относительным преобладанием гормонального звена в ближайшем послеоперационном периоде рассматривается как одно из неблагоприятных проявлений постишемического периода.
Длительно существующие высокие концентрации катехоламинов в крови отрицательно влияют на микроструктуру миокарда, вызывают аритмию, резко увеличивают содержание циклических нуклеотидов в клетках сердечной мышцы (Podzweit I. et al., 1981). Ежедневное, в течение 6 недель введение адреналина в дозе 100 мкг/кг веса вызывает изменения обмена веществ и функции органов, характерные для состояния длительной физической тренировки.
Установлено, что токсические дозы катехоламинов могут способствовать развитию аритмий (П.Ф. Литвицкий, 1979), уменьшению эффективности механической работы, повышению потребления кислорода, гипоксемии и развитию феномена «кислородной утечки» (М.Е. Райскина и др., 1963, И.В. Голубева, 1972, Opie L.H. et al., 1979).
Это действие катехоламинов сопровождается сменой прессорных влияний на депрессорные и вызвана стимуляцией бета2-адренорецепторов и может быть предотвращена введением кальция и бета-адреноблокадой (Opie L.H. et al., 1979). Введение токсических доз катехоламинов приводит к некротическим изменениям, воспалению и фибринозному перерождению миокарда (Haft J.I., 1973), нарушению структуры митохондрий (К.С. Митин и др., 1975).
Защитным действием к катехоламиновым некрозам миокарда обладают бета-адренолокаторы (В.В. Малышев и др., 1986 Kulig A. et al., 1973) и антиоксиданты типа витамина Е и этанол. Положительный эффект бета-адреноблокаторов наблюдается и при остром инфаркте миокарда (Edoute Y et al., 1981) и при нейрогенных поражениях миокарда, вызванных трехчасовой электростимуляцией дуги аорты (И.С. Заводская и др., 1977).
Большой цикл исследований по проблеме влияния стресса на кровообращение человека провели P. Obrist (1985) и Е.В. Белова (1987). Согласно этим работам, при стрессе характерно увеличение ЧСС, повышение минутного обьёма кровобращения (МОК) и систолического АД, при отсутствии повышения общего периферического сопротивления сосудов (ОПС), а при корректурной пробе – увеличение ОПС и диастолического АД, без повышения МОК.
В других работах (Б.М. Федоров, 1991) отмечено, что во время стрессового воздействия при напряженной умственной работе показатели кровообращения в различных случаях изменяются не однотипно. В ряде наблюдений вначале отмечается снижение ОПС сосудов и увеличение МОК. По мере нарастания стрессорной реакции характер изменений системной гемодинамики существенно изменялся. При этом снижение тонуса сосудов большого круга кровообращения сменяется его повышением. Соответственно более резко повышается АД и менее значительно повышается или даже снижается МОК.
В стрессорных ситуациях изменяется сердечная деятельность, состояние артериальных и венозных сосудов, микрогемоциркуляция. Учащение сердечных сокращений лишь до определенного предела отражает выраженность стрессорной реакции.
Нарушения кровообращения четко коррелируют с динамикой стрессорных реакций. Влияние стрессов на кровообращение на микроциркуляторном уровне выражается в констрикции артериол, появлением агрегатов эритроцитов, нарушением сосудистой проницаемости, замедлением кровотока в венах, а затем в артериолах, возникновением стазов.
Установлено, что изменения активности симпатической нервной системы, общего периферического сопротивления сосудов и среднего артериального давления в ходе хирургического стресса имеют однонаправленный характер (Т.С. Тапбергенов, 1992).
При психоэмоциональном стрессе отмечено изменение реологических свойств крови, в частности, увеличение ее вязкости и проницаемости стенок венулярных сосудов.
Как показано исследованиями Т.С. Тапбергенова (1992), при хирургическом стрессе степень выраженности изменений показателей вегетативной регуляции и центральной гемодинамики зависят от исходного состояния каждого из них и этапа оперативного вмешательства. При исходно высоком тонусе симпатического отдела вегетативной нервной системы его влияние на среднее артериальное давление и тонус сосудов компенсирует, ожидаемое в начале операции, угнетение сердечно-сосудистой системы, а исходно низкая симпатическая активность вегетативной регуляции усугубляет гемодинамические нарушения в ходе хирургического вмешательства.
В происхождении различных вариантов изменений гемодинамики в стрессорных и экстремальных ситуациях существенное значение имеют изменения венозного возврата крови к сердцу. Так развитие прессорной реакции, вызванной введением катехоламинов, в начальном периоде связано с изменениями тонуса артерий и соответственно повышением общего периферического сопротивления.
При дальнейшем развитии прессорной реакции, вызванной катехоламинами, характерно повышение роли венозного возврата в формировании величины сердечного выброса. Роль этих изменений в поддержании высоких показателей АД становится весьма существенной, составляя до 50 % вклада в реализацию эффекта гипертензии (Б.Я. Зонис, 1986). Давление в венах, состояние окружающих их тканей, в частности скелетных мышц, и особенно симпатическая стимуляция венозного тонуса, чувствительность альфа-адренорецепторов, обеспечивающих констрикторные эффекты – все это отражается на изменении просвета сосудов, емкости венозного русла и возврате крови к сердцу.
Показана возможность в условиях патологии значительного увеличения объёма вен и задержки в них крови при сочетании повышенного давления в растянутых венах с адренергической стимуляцией венозных «сфинктеров», расположенных в области венозных клапанов. При стрессорных воздействиях возникновение коллаптоидных состояний может быть следствием резкого снижения возврата венозной крови к сердцу. Повышение тонуса венозных сосудов и увеличение венозного возврата рассматривается как существенный фактор в патогенезе гипертонии.
Анализ результатов реакции торможения миграции лимфоцитов (РТМЛ) с митогеном конкавалином А (Соn A) в присутствии различных концентраций норадреналина, позволяющей оценить чувствительность адренорецепторов (В.Р. Вебер, 1992), показал, что на разных этапах хирургического стресса имеет место снижение индекса чувствительности адренорецепторов лимфоцитов к норадреналину (табл. 1).
Индекс торможения миграции лимфоцитов при хирургическом стрессе (на 100 клеток, М ± m)
Источник