Природа возникновения стресс-коррозионных разрушений нефтегазопроводов
Помимо обычных коррозионных процессов, в некоторых условиях имеют место иные формы разрушения трубопроводов, инициированные внешней средой. В частности, в присутствии сероводорода и воды в перекачиваемом продукте может идти процесс коррозионного растрескивания под напряжением (стресс-коррозии). Его определяют как макрохрупкое разрушение, развивающееся в результате одновременного воздействия на металл агрессивной среды и растягивающих напряжений.
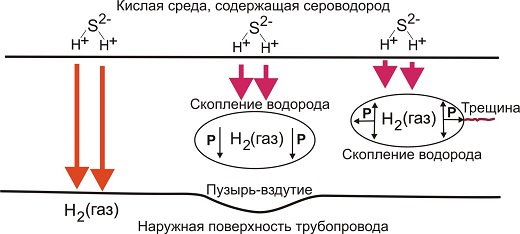
Рис. 1. Механизм внутреннего КРН
Механизм стресс-коррозионного разрушения промысловых трубопроводов иллюстрируется на рис. 1. Водород в форме атомов или ионов, образующийся вследствие диссоциации сероводорода, диффундирует вглубь металла. Часть водорода проходит сквозь стенку трубопровода, остальной водород или растворяется в кристаллической решетке железа, вызывая ее охрупчивание, или скапливается в местах существования дефектов кристаллической решетки (примеси, дислокации и т.д.), вызывая резкое локальное увеличение давления. Скопление водорода вблизи наружной поверхности трубопровода может вызывать возникновение пузырей на поверхности металла, скопление водорода в глубине стенки вызывает образование трещиноподобного дефекта.
Примером образующихся трещин может служить рис. 2. На рисунке показаны стадии протекания процесса: образование первоначальной водородной трещины (ВР) и последующего долома металла (ступенчатое растрескивание).
Рис. 2. Внешний вид стресс-коррозионных трещин
Опасность сероводородного коррозионного растрескивания большинства используемых в нефтегазовом комплексе конструкционных сталей появляется при парциальном давлении сероводорода более 0,00035 МПа и в интервале температур -10….+50 о С. Хотя в отсутствие сероводорода наводороживание в нормальных условиях было зафиксировано только при рН + + HS — расширяет этот диапазон до рН=1,5-11,5, хотя зоной наибольшей опасности остаются, конечно, кислые среды. При этом степень коррозионного влияния сероводорода значительно менее опасна, чем повышение интенсивности наводороживания трубной стали.
Таким образом, степень опасности внутренней стресс-коррозии трубопроводов определяется следующими основными факторами:
- концентрация (парциальное давление) сероводорода;
- температура и общее давление в системе;
- микроструктура стали;
- водородный показатель (рН) коррозионной среды;
- механические свойства стали;
- величины конструкционных напряжений в металле.
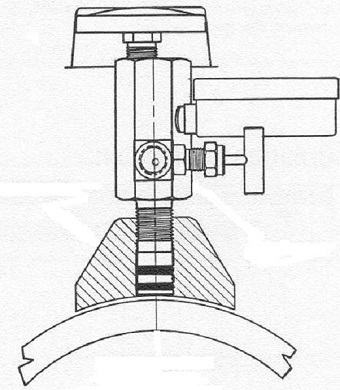
Оценка опасности описанного явления на действующем объекте может быть выполнена путем установки специальных наружных датчиков водорода (рис. 3), определяющих количество водорода диффундирующего насквозь, через стенку трубопровода, путем измерения парциального давления или по изменению параметров электрохимической реакции с его участием.
Рис. 3. Конструкция датчика давления водорода
Датчики давления менее чувствительны, чем электрохимические датчики и у них меньше время отклика. В то же время датчики давления обладают высокой надежностью и минимальными требованиями к эксплуатации, и техническому обслуживанию, в отличие от электрохимических датчиков.
Мониторинг проницаемости водорода не дает количественных значений скорости роста стресс-коррозионных дефектов, а определяет количество водорода, прошедшего через стенку трубопровода на данную единицу площади. Изменение данного количества водорода в процессе эксплуатации может показывать эффективность работы ингибиторов коррозии и дает основания для аналитической оценки потенциальной скорости роста стресс-коррозионных дефектов.
Источник
Стресс-коррозия
Это — явление коррозионного растрескивания под напряжением на внешней поверхности трубы под слоем защитной изоляции и при приложении к трубопроводу катодной поляризации — электрохимической защиты.
Практика эксплуатации трубопроводов указывает, что появление колоний трещин стресс-коррозионного происхождения совпадает с участками отслоившейся изоляции. Развитие стресс-коррозии в на-
иболыпей степени выявляется на головных участках трубопровода после компрессорных станций, на местах спусков и подъемов.

Несмотря на обширные исследования, до настоящего времени мнения [204, 205] о природе стресс-коррозии противоречивы. Выделяют два типа (механизма) стресс-коррозии: анодного растворения металла и инициируемого водородом коррозионного растрескивания.
Локализацию анодного растворения металла связывают с двумя факторами: снижением потенциала растворения и (или) локальным нарушением пассивности стали под действием концентрации напряжений; разупрочнением объемов металла вблизи вершины трещины под воздействием коррозионно-активной среды, приводящей к преимущественному растворению участков с повышенной концентрацией дефектов (линии сдвига, межфазные границы и т.д.) [205].
Водородный механизм стресс- коррозии обусловлен разрядом ионов водорода на поверхности стали, внедрением их в металл и дальней
шей диффузией в области с повышенной концентрацией напряжений, в которых при условии достижения критической концентрации водорода происходит зарождение микротрещин.

Однако в практике исследования шлифов с трещинами стресс-коррозионного происхождения часты случаи, когда впереди вершины трещины наблюдаются лидирующие микротрещины (показана стрелкой на рис. 5.89). (Показан характер трещины в трубе диаметром 1420 с толщиной стенки
16 мм, испытавшей трещинообразование при Рраб = 7 МПа в районе Краснотуринска). Раскрытие таких микротрещин в стали, производимой по технологии контролируемой прокатки, происходит поперек толщины стенки. Последнее предполагает более легкое развитие лидирующих микротрещин в плоскости прокатки. Фрактографический анализ хрупких изломов (табл. 5.14) подтверждает более значительное ослабление когезивной прочности границ зерен стали в плоскости прокатки по сравнению с поперечным направлением, т.е. в направлении роста стресс-коррозионной трещины. С целью получения хрупкого излома пробы стали испытывали на изгиб при -120. —150 °С.
Участок исследуемого трубопровода с защитным покрытием имел катодную защиту с U = -0,95 В. На наружной поверхности трубы общая коррозия выражена в виде тонкой пленки оксидов толщиной — 0,2 мм. Видны также точечные дефекты (питтинг) большой плотности диаметром до 0,4 мм и глубиной до 0,2 мм. На поверхности трещины видны многочисленные трещины, вытянутые вдоль образующей трубы. Из табл. 5.14 видно, что пробы стали 10Г2Т (ТУ 14-3-1512-87) показывают существенное ослабление границ зерен феррита и колоний перлита.
Особенно существенно увеличение доли межзеренного разрушения вдоль плоскостей проката трубного листа по сравнению с поперечным направлением прокатки (см. табл. 5.14) В среднем степень зернограничного ослабления в плоскости прокатки в 1,5—3,5 раза выше, чем поперек стенки трубы. Факт большей степени ослабления границ зерен вдоль плоскости проката согласуется с тенденцией части трещин стресс-коррозии распространяться вдоль ферритно-перлит- ной строчечности, образуя уступы вдоль траектории распространения трещины (стрелка на рис. 5.89). Вторым фактором, облегчающим распространение трещин вдоль плоскости прокатки, являются раскатанные неметаллические включения. В ряде случаев эти участки излома, образующиеся при распространении хрупкой трещины вдоль границы раздела феррит-включение, занимают до 50% и более площади излома (рис. 5.90). Иногда удается обнаружить на поверхности раздела включение-матрица отпечатки перлитных колоний (рис. 5.90, б). Последнее указывает, что плоскость разрушения проходит как по границе феррит-включение, так и по границе перлит-включение. Темные

Таблица 5.14. Доля межзеренного разрушения в стали 10Г2Т разрушившегося газопровода при давлении 7 МПа
Рис. 5.90. Поверхность разрушения в плоскости проката пробы из трубной стали 10Г2Т (угольная реплика), а — х 2000, б — х 3400
фигуры на рисунке 5.90, б соответствуют сохранившимся на реплике частицам тонких пластинчатых включений оксидного типа.
Согласно [204], при визуальном анализе труб, испытавших при эксплуатации трещинообразование, можно выделить две группы труб. Первая группа труб характеризуется следующими общими признаками: хрупким разрушением, отсутствием макропластичес- кой деформации внешних стенок; развитием трещин вдоль оси трубы; преимущественно межзеренным характером развития трещин; началом разрушения от очагов на внешней поверхности труб.
Вторая группа труб обладает следующими общими признаками, существенным образом отличающих ее от первой группы: около излома отсутствовали области с множественными продольными трещинами; внутри стенки трубы вдоль ее оси развивалось макрорасслоение; очаги разрушения расположены во внутренних объемах стенки трубы на поверхности расслоения; от очагов зарождения трещины развивались в разных направлениях.
Анализ содержания диффузионно-подвижного и остаточного водорода в стали указывает [204], что аварийные разрушения труб связаны с инициируемым водородом коррозионным растрескиванием. Сталь наводороживается только в окрестности трещины. Наводороживания всей стенки трубы не происходит.
Зарождение микротрещин во второй группе труб происходит формированием расслоения вследствие повышенного уровня внутренних напряжений. Рост этих микротрещин в направлении внешней стенки происходит по усталостному механизму с образованием усталостных бороздок. После выхода этих трещин на внешнюю стенку трубы и попадания электролита в полость трещины характер роста трещин в первой и второй группах труб совпадает.
Для объяснения [204] специфики роста трещин второй группы труб по сравнению с первой не обязательно привлечение представлений об участии усталостного механизма в развитии трещин. Появление расслоений возможно связано с накоплением водорода на границе раздела феррит-перлит, что вызывает существенное снижение когезивной прочности границ зерен. Приведенные в табл. 5.14 данные о существенно большей доли межзеренного разрушения в плоскости прокатки подтверждают этот вывод.
Наряду с вкладом локального наводороживания и повышенного уровня микронапряжений в развитие стресс-коррозии необходимо учитывать специфику коррозионно-активных сред. По данным [205], скорость электрохимического растворения металла в грунтах из мест, где произошли аварии (районы Мурома, Ухты, Мышкина, Красноту — ринска), на порядок выше, чем в местах, где такого растрескивания труб не произошло. В местах проявления стресс-коррозии наблюдается пониженное значение pH = 5,5. По данным анализа 25 образцов электролита под покрытием на участках трансканадского трубопровода [206], на которых выявлена стресс-коррозия, эти электролиты представляют сильно разбавленные растворы с низкими значениями pH (lt; 7,5). Растворы содержали бикарбонаты, угольную кислоту и некоторые другие вещества.
В последние годы интенсивно обсуждается роль анаэробных бактерий на коррозионное растрескивание под напряжением. Данные на этот счет противоречивы. Сравнение результатов микробиологического анализа со степенью коррозии под напряжением показали возможность вклада сульфатредуцентных и кислотопродуцентных бактерий в общий эффект [206]. В пределах участков трубопровода, имеющих колонии трещин, их количество, длина и глубина возрастают с увеличением концентрации бактерий. Предполагается, что с ростом концентрации бактерий повышается содержание С02, Н2 и органических кислот.
Скорость коррозии в среде, содержащей сульфатвосстанавливаю- щие бактерии, значительно (в 3,5-5 раз) выше, чем в среде, содержащей только H2S (500 мг/л) [207], что обусловлено облегчением анодного процесса растворения металла вследствие образования рыхлой пленки железа. Скорость коррозии металла в присутствии сульфатвосстанав- ливающих бактерий и ионов Fe2+ значительно (в 1,6—2,5 раза) выше, чем в среде, содержащей только бактерии. В этом случае на поверхности металла защитная пленка сульфида железа не образуется.
Имеются предположения [208], что выделяющийся в процессе жизнедеятельности сульфатвосстанавливающих бактерий H2S образует на поверхности металла рыхлый слой сульфида железа. Этот слой создает с металлом местную гальваническую микропару. При этом сульфид железа выступает в роли катода.
Источник
Стресс коррозия что это такое
Окислительный стресс. Патогенез большинства заболеваний включает избыточную активацию свободно-радикальных процессов, нарушение функционирования систем антиоксидантной защиты, что неизбежно приводит к формированию в организме окислительного стресса (ОС). Механизмы формирования ОС при разных патологиях довольно универсальны и связаны, в первую очередь, с нарушением гомеостаза и окислительно-восстановительных процессов. Основными мишенями повреждения в организме в условиях ОС являются молекулы белков, липидов и нуклеиновых кислот, которые подвергаются окислительной модификации и в дальнейшем, как правило, не способны выполнять свои функции. В связи с этим поиск и разработка способов коррекции окислительного стресса являются крайне актуальной проблемой современной медицины. Один из способов, который может быть эффективен в клинических условиях, заключается в применении веществ, обладающих широким спектром антиокислительного действия, так называемых антиоксидантов.
Классификация антиоксидантов. До сих пор не существует единой классификации антиоксидантов, что во многом обусловлено их большим разнообразием, различиями химической структуры и молекулярных механизмов, благодаря которым обеспечивается антиоксидантная защита биомолекул. Антиоксиданты могут быть донорами протонов, хелаторами ионов металлов переменной валентности, могут предотвращать развитие цепных окислительных процессов, локально снижать концентрацию кислорода и предотвращать его включение в окисление, переводить перекиси в стабильные продукты окисления, инактивировать свободные радикалы и др. [15]. Чаще всего антиоксидант обладает каким-либо преимущественным механизмом действия в организме, хотя зачастую обеспечивает свой эффект благодаря одновременному влиянию на разные звенья метаболизма по нескольким механизмам.
Условно выделяют две основные группы антиоксидантов: природные и синтетические. Существуют также вещества – синергисты, которые обладают низким антиоксидантным эффектом, но способны усиливать эффект других антиоксидантов (к ним можно отнести, например, лимонную и никотиновую кислоты). Группа природных антиоксидантов самая многочисленная и включает вещества, выделенные из растительных и животных тканей. На растительных компонентах основаны многие биологически активные добавки, обладающие антиоксидантными свойствами. Они составляют существенную часть фармакологического рынка. К природным антиоксидантам относятся также ферменты (супероксиддисмутаза, каталаза, глутатионовая система и др.), неферментные соединения – белки (альбумин, трансферрин, ферритин, лактоферрин, церулоплазмин), низкомолекулярные соединения (витамины Е и С, убихинон, билирубин, мочевая кислота, стероидные гормоны и др.). К группе синтетических антиоксидантов относятся многие лекарственные препараты, тормозящие или блокирующие процессы свободнорадикального окисления, такие, например, как дибунол, эмоксипин, пробукол и др.
По способности растворяться в разных средах различают гидрофильные (аскорбиновая и мочевая кислоты, цистеин, карнозин и др.) и липофильные (токоферолы, ретинол, билирубин и др.) антиоксиданты. Существует деление антиоксидантов по принципу их действия: антиоксиданты прямого действия обладают непосредственными антирадикальными свойствами, которые можно обнаружить в тестах in vitro. У антиоксидантов косвенного действия антиоксидантный эффект является опосредованным и проявляется в результате их влияния на синтез и превращение жизненно-важных биологически активных веществ (ферментов, витаминов, гормонов и др.).
Выбор антиоксидантов для использования в медицине. Накоплен обширный экспериментальный и клинический материал по использованию антиоксидантов. В медицине главным образом их используют в качестве дополнительных средств к базовой терапии. Многие лекарственные препараты кроме основного терапевтического эффекта проявляют и антиоксидантные свойства, как, например, гепатопротекторы (карсил, легалон, гептрал и др.), препараты, используемые при лечении сердечно-сосудистой и неврологической патологии (мексидол, эмоксипин, актовегин, кортексин, реамберин и др.). Однако в зависимости от условий и концентрации антиоксиданты могут проявлять и противоположное антиоксидантному – прооксидантное – действие. Известно, например, что каротины являются полиненасыщенными соединениями, поэтому сами могут окисляться по радикальному механизму и выступать в качестве прооксидантов. В определенных условиях, например, в присутствии ионов металлов переменной валентности, прооксидантный эффект проявляет аскорбат. Витамин Е как антиоксидант наиболее эффективен в комплексе с другими жиро- и водорастворимыми восстановителями (аскорбиновой кислотой, убихиноном, флавоноидами), в отсутствие которых он быстро инактивируется или переходит в токофероксильный радикал, способный инициировать новые цепи окисления ненасыщенных липидов, то есть тоже становится прооксидантом [15].
Выбор конкретного антиоксиданта, точные показания и противопоказания к его применению пока недостаточно разработаны для каждого конкретного заболевания. Нет информации о взаимодействии лекарственных средств природного происхождения с синтетическими препаратами. Кроме того, антиоксиданты могут вызывать аллергические реакции, обладать токсичностью, проявлять низкую эффективность, не всегда поддаются стандартизации, сохраняется также возможность их передозировки и т.д. Поэтому поиск веществ с максимальным антиоксидантным действием и минимальными побочными эффектами в условиях ОС продолжается и остается важной проблемой. В идеале анитоксидант должен проявлять выраженное антиоксидантное действие в широком диапазоне концентраций, быть природным, гидрофильным, обладать хорошей биодоступностью, быть нетоксичным и не образовывать токсичных продуктов при взаимодействии с активными формами кислорода, не оказывать негативных эффектов в случае передозировки, иметь хорошую совместимость с другими препаратами.
Основные свойства карнозина. Многочисленные литературные источники, а также собственный опыт работы, позволяют предполагать, что антиоксидант карнозин – природный дипептид β-аланил-L-гистидин – отвечает практически всем требованиям, предъявляемым к идеальному антиоксиданту. Он синтезируется и содержится в мышечной и нервной ткани человека, легко усваивается и проникает через гематоэнцефалический барьер, обладает высокой биодоступностью и мембраностабилизирующим действием, относится к низкомолекулярным гидрофильным антиоксидантам прямого действия, хотя способен оказывать и опосредованное влияние на систему антирадикальной защиты организма [3]. Об опосредованном действии карнозина свидетельствуют, в частности, результаты экспериментов, проведенных на крысах, которые показали, что карнозин ускоряет метаболизирование кортизола и норадреналина, высвобождающихся в кровь животных при стрессе [42]. Снижение уровня гормонов стресса в крови опосредованно приводит к снижению выраженности ОС. Кроме того, у карнозина не выявлено побочных эффектов, к нему нет привыкания, нет опасности его передозировки, он не накапливается в организме при длительном применении, так как его избыток подвергается расщеплению ферментом карнозиназой на составляющие аминокислоты, которые легко выводятся из организма [3].
Первые положительные биологические эффекты карнозина объясняли его рН-буферными свойствами, однако после выявления его прямого антиоксидантного действия [23], карнозин стали рассматривать не только как буфер для протонов, но и как буфер для металлов с переменной валентностью и активных форм кислорода, то есть как классический антиоксидант. В последующем были выявлены антигликирующие [39], антикросслинкинговые [40] свойства карнозина, которые являются, по сути, отражением его антиоксидантных эффектов.
Клиническое применение карнозина. Создателями первой инъекционной лекарственной формы карнозина были ученые Харьковского физиотерапевтического института. При его введении подкожно по 0,5–1,0 мг (курс состоял из 12–15 инъекций) была получена высокая терапевтическая эффективность при лечении инфекционных и ревматических полиартритов, язвенных заболеваний желудочно-кишечного тракта [17, 29]. Позже было продемонстрировано положительное действие карнозина при заживлении ран роговицы [31] и ткани легкого [20]. Большое место в изучении ранозаживляющего действия карнозина принадлежит японским исследователям. Ими был создан препарат Z-103 на основе комплексного соединения, образуемого карнозином и ионами цинка (L-карнозин-Zn2+), который обладал выраженным противоязвенным эффектом, уменьшал повреждение слизистой желудка, вызванное разными формами стресса и химическими агентами [47]. Японским ученым принадлежит и приоритет использования карнозина при онкологических заболеваниях [49]. Карнозин (3 г/день) в сочетании с радиотерапией при лечении больных раком молочной железы значительно снижал побочные эффекты облучения – радиационное повреждение кожи, интоксикацию организма, повышал иммунитет и увеличивал вероятность излечения в несколько раз. Карнозин оказался эффективным и для предупреждения кахексии, вызываемой химиотерапией при лечении рака (2 г/день в течение 10 дней перед интенсивной химиотерапией) [49]. В экспериментальных исследованиях на культурах опухолевых клеток показано, что карнозин способен полностью подавлять пролиферацию глиобластомы человека, при этом обнаружено снижение уровня активных форм кислорода и повышение активности митохондриальной супероксиддисмутазы в клетках опухоли [22].
Отечественным ученым принадлежит приоритет открытия способности карнозина предотвращать возрастное помутнение хрусталика глаза [4]. Основной причиной помутнения хрусталика при старческой катаракте являются свободнорадикальные реакции, приводящие к окислительной модификации липидов и белков кристаллинов тканей глаза. В ходе развития катаракты в хрусталике происходит значительное снижение эндогенных антиоксидантов глутатиона и карнозина. В клинических исследованиях была доказана эффективность препарата в виде глазных капель для лечения катаракты, содержащего 5 %-й раствор карнозина. Позже при разработке глазных капель был успешно применен природный дипептид, родственный карнозину, N-ацетилкарнозин [34]. Карнозин в виде 5 %-го раствора успешно использовали и для лечения сезонного аллергического риноконьюнктивита, при этом отпадала необходимость дополнительного назначения антигистаминных препаратов [2]. Карнозин нашел свое применение и для лечения воспалительных заболеваний пародонта у пациентов с несъемными ортодонтическими конструкциями: 5 %-й раствор этого дипептида оказывал выраженное иммунокоррегирующее действие и повышал активность ферментов антиоксидантной защиты в слюне [25].
Карнозин успешно применяют в кардиологической практике. В Центре сердечно-сосудистой хирургии им. А.Н. Бакулева используют кардиоплегический раствор, содержащий L-карнозин и N-ацетилкарнозин, при операциях на остановленном сердце, что позволяет в несколько раз увеличить длительность операции без признаков некротического повреждения тканей сердца в операционном поле [5].
В настоящее время в России в качестве источника карнозина часто применяют таблетированную биологически активную добавку под названием севитин. Каждая таблетка севитина содержит 0,15 или 0,25 грамм карнозина. Благодаря работам, проводимым в Московском Научном центре неврологии по изучению биологических свойств карнозина (севитина), было показано, что этот препарат способствует восстановлению мозгового кровообращения и поддержанию функционального состояния сердечно-сосудистой системы, оказывает регулирующее действие на активность иммунной системы [24]. Проводятся исследования, направленные на получение новых карнозин-содержащих препаратов для использования в клинических условиях. Имеются сообщения о создании и испытании нанокомплексов, содержащих карнозин, включенный в состав фосфолипидных наноструктур [13]. Использование таких нанокомплексов позволяет обеспечить устойчивость карнозина к действию карнозиназы при его доставке к месту назначения, что может существенно увеличить эффективность воздействия этого дипептида.
Применениее карнозина при психоневрологических и психических расстройствах. Известно, что ОС развивается при болезни Паркинсона и Альцгеймера [46], при инсульте [38], неврозах [1], шизофрении [26], депрессии [10], при аддиктивных расстройствах, в частности, при алкоголизме [21, 41, 50]. Клетки нервной системы очень чувствительны к свободнорадикальному окислению в силу многих факторов: высокой интенсивности обменных процессов и высокого уровня потребления кислорода, большого количества липидов с полиненасыщенными жирными кислотами, повышенного содержания связанных ионов железа (индукторов окисления) и низкого содержания его белков-переносчиков, образования активных форм кислорода в ходе клеточного метаболизма, которые выполняют в нейрональных клетках функцию вторичных мессенджеров, участия свободных радикалов в нейрорегуляции и др. [3, 15]. Именно это определяет особую необходимость защиты клеток нервной ткани от свободно-радикального окисления с помощью природных антиоксидантов, способных преодолевать гематоэнцефалический барьер, к которым относится и карнозин.
Положительные результаты были получены при добавлении карнозина (2,0 г/сутки) к базовой терапии больных с хронической дисциркуляторной энцефалопатией. Такое лечение приводило к повышению устойчивости липопротеинов плазмы крови к Fe2+-индуцированному окислению, стабилизации эритроцитов по отношению к кислотному гемолизу, интенсификации дыхательного взрыва лейкоцитов и усилению эндогенной антиоксидантной защиты организма, улучшению когнитивных функций головного мозга пациентов [6]. То есть карнозин оказывал антиоксидантный, мембраностабилизирующий и иммуномодулирующий эффекты при данной патологии.
Существенное улучшение клинического состояния пациентов наблюдалось при введении карнозина в дозе 1,5 г/сут в течение 30 дней дополнительно к традиционной терапии при лечении болезни Паркинсона [28]. Использование карнозина позволило снизить токсические эффекты базовой терапии (побочные действия антипаркинсонных препаратов). У больных отмечалось статистически значимое уменьшение неврологической симптоматики (улучшение координации движений). Была выявлена положительная корреляция между активацией антиоксидантного фермента супероксиддисмутазы в эритроцитах и снижением неврологической симптоматики. Добавление карнозина в схему лечения приводило к достоверному снижению гидроперекисей в липопротеинах плазмы крови и значительно увеличивало сопротивляемость липопротеинов низкой и очень низкой плотности к Fe2+-индуцируемому окислению, а также к уменьшению количества окисленных белков в плазме крови. Таким образом, добавление карнозина к базисной терапии значительно улучшало не только клинические показатели, но и повышало антиоксидантный статус организма у пациентов с болезнью Паркинсона.
Успешное применение карнозин нашел и при шизофрении. Рандомизированное двойное слепое плацебо-контролируемое исследование выявило, что включение карнозина (2,0 г/сут) в качестве дополнения к основной терапии при лечении больных шизофренией улучшало когнитивные функции пациентов [35].
Коррекция окислительного стресса карнозином у больных алкоголизмом. Доказано, что у больных алкоголизмом ОС вносит большой вклад в формирование соматических осложнений [19], нарушение иммунного статуса [9, 11], индукцию апоптоза [36]. При алкоголизме важную роль в формирование ОС может вносить этанол, концентрация которого в организме больного существенно превышает норму, а также токсический метаболит этанола – ацетальдегид [8], уровень которого в организме также возрастает при алкогольной интоксикации. Ацетальдегид способен связываться со многими биологическими молекулами (белками плазмы, гемоглобином, факторами свертывающей системы крови, липидами и др.), образуя с ними альдегидные аддукты, которые откладываются и накапливаются в различных тканях (печени, мозге, сердце, мышцах, кишечнике) [43, 48].
Высокие показатели окислительной модификации биомолекул и активности аминотрансфераз сыворотки крови обнаружены у больных алкоголизмом, находящихся в состоянии абстиненции [7]. В другой работе повышенное содержание карбонилированных белков и активности аминотрансфераз сыворотки крови выявлено у пациентов с алкогольным делирием, инфицированных вирусами гепатита С или иммунодефицита человека [30]. Показана взаимосвязь между уровнем окисления (карбонилирования) белков плазмы крови с тяжестью проявлений абстинентного синдрома у пациентов [16]. Есть мнение, что метаболической основой возникновения алкогольного психоза является накопление ацетальдегида, который, взаимодействуя с серотонином, образует токсические продукты, обладающие галлюциногенными свойствами [12]. У больных алкогольным делирием с преобладанием психотического компонента выявлено повышенное содержание окисленных белков в эритроцитах, в плазме крови и низкий уровень ПОЛ [18]. Высокое содержание окисленных белков наблюдалось и у больных с алкогольной энцефалопатией [14]. Таким образом, активация свободно-радикальных процессов, приводящая к накоплению продуктов окислительной модификации биомолекул, вносит существенный вклад в клиническое течение алкоголизма и может определять его особенности, что делает крайне важным изучение эффектов антиоксидантов при данной патологии.
Проведено специальное плацебо-контролируемое исследование эффективности карнозина при коррекции ОС у больных алкогольной зависимостью на этапе формирования ремиссии [21, 32]. Больные после базового лечения принимали карнозин в дозе 1,2 г/сут в течение одного месяца вне стационара. Отмечено, что после лечения в стационаре в организме больных сохранялся ОС на высоком уровне. Через один месяц, в течение которого проводилось исследование, в группе сравнения (у больных, не принимавших никаких препаратов на этапе формирования ремиссии), выраженность ОС осталась на том же уровне, что и в начале исследования. В группе больных, которые принимали карнозин, отмечалось достоверное снижение карбонилированных белков и продуктов ПОЛ в плазме крови до величин, соответствующих здоровым лицам. Прием пациентами карнозина в течение месяца приводил также к повышению активности СОД плазмы и снижению активности аминотрансфераз сыворотки крови. Эти результаты показывают, что прием карнозина эффективно снижает выраженность ОС в организме больных алкоголизмом. При этом нежелательных побочных эффектов не наблюдалось.
Защита карнозином биомолекул от окисления, индуцированного этанолом и ацетальдегидом in vitro. В экспериментальных исследованиях было доказано, что карнозин в концентрации 5 мМ повышает устойчивость эритроцитов больных алкоголизмом к гемолизирующему действию кислоты [44], подавляет окислительную модификацию белков и липидов плазмы крови, вызванную как этанолом, так и ацетальдегидом. Методом электрофореза в полиакриламидном геле выявлено, что инкубация крови с ацетальдегидом приводит к появлению высокомолекулярных белков в плазме, которые не обнаружены ни в контрольных образцах, ни в образцах с этанолом. Это свидетельствует об ацетальдегид-индуцируемом образовании белковых агрегатов, которые образуются в результате свободнорадикального окисления. В образцах крови с ацетальдегидом, в которые был добавлен карнозин, высокомолекулярных белков не выявлялось. То есть карнозин препятствовал ацетальдегид-индуцируемому образованию агрегатов белков плазмы крови. В целом эти исследования показали, что положительный эффект карнозина при лечении больных алкоголизмом может быть обусловлен, в том числе, и способностью этого дипептида защищать белки и липиды от окислительного повреждения, вызванного этанолом и ацетальдегидом.
Применение карнозина при физиологических состояниях, сопровождающихся активацией свободно-радикальных процессов. ОС может развиваться не только при патологических процессах, но и при больших физических нагрузках, а также при физиологическом старении организма. Поэтому уже сегодня карнозин находит широкое применение как общеукрепляющее средство для здоровых людей в условиях физического и психологического напряжения, при действии различных неблагоприятных факторов, в экстремальных условиях. Карнозин применяют для ускорения процессов восстановления утомленных мышц и повышения их работоспособности у спортсменов [33] и у здоровых пожилых людей, стремящихся к активному образу жизни [37]. В экспериментальных условиях было показано геропротекторное действие карнозина. В опытах с использованием специально выведенной линии быстростареющих мышей было доказано, что включение в их рацион карнозина приводит к замедлению процесса старения животных за счет повышения антиоксидантного статуса их организма [27]. Есть сообщения об антистрессорном действии карнозина, а также о возможном его использовании у людей, страдающих нарушениями сна [24]. Перспективны разработки использования карнозина в косметической отрасли, что подтверждают имеющиеся данные о способности карнозина предотвращать структурные изменения коллагена в коже, препятствовать потере ее эластичности [45].
Заключение
Представленные данные об успешном использовании карнозина при разных патологиях и при физиологических состояниях, сопровождающихся активацией свободно-радикального окисления, демонстрируют перспективность использования карнозина в качестве эффективного антиоксиданта, протектора тканей от различных неблагоприятных факторов, индуцирующих развитие окислительного стресса.
Источник