Тепловой стресс
Содержание
Тепловой стресс у человека в условиях двигательной активности [ править | править код ]
Реакция нейроэндокринной системы при выполнении физических упражнений в условиях повышенных температур (здесь свыше 35 °С) существенно отличается от таковой при термическом воздействии в состоянии покоя в сауне. И это справедливо, поскольку выделение нейротрансмиттеров и гормонов может происходить под влиянием разнообразных стимулов, а двигательная активность влияет на характер функционирования нескольких сигнальных путей, изменяя их одновременно или последовательно (Giustina; Veldhuis et al., 1998). Несмотря на то что основная масса этих изменений может быть отнесена на счет повышения тонуса симпатической нервной системы (увеличения вентиляции легких, потребления кислорода, ЧСС) или возрастания активности гипоталамо-гипофизарно-надпочечниковой и/или симпатоадреномедуллярной систем, гормональный ответ на тепловой стресс и физическую нагрузку не всегда легко интерпретировать. Например: а) двигательная активность и термические стрессоры оказывают синергический эффект на концентрацию одних гормонов в плазме (норадреналина, адреналина, кортизола), в то время как в отношении других (дофамина, соматотропного гормона) такого синергизма не наблюдается (Brenner et al., 1997); б) концентрация пролактина в плазме под влиянием теплового воздействия возрастает в состоянии покоя сильнее, чем во время двигательной активности (Kukkoncn-Harju 1 а, 1989);в) концентрация кортизола в плазме может как возрастать, так и снижаться, в зависимости от циркадного ритма (Thuma et al., 1995).
В условиях одновременного воздействия физической нагрузки и теплового стресса взаимодействие нейротрансмиттеров и нейропептидов затрудняет детальное описание процессов терморегуляции организма. Одним из показательных примеров такого поведения является соматотропный гормон. Например, секреция соматотропина регулируется под влиянием нейропептидов (галанина, тиреолиберина, нейропептида Y, кальцитов и βэндорфина), нейротрансмиттеров (ацетилхолина, норадреналина, дофамина, 5-НТ и ГАМК), метаболических субстратов (глюкозы крови, L-аргинина) и гормонов (гонадального тестостерона, эстрогенов, соматостатина и тиреоидного гормона) (Giustina; Veldhuis et al., 1998). Идентифицированы несколько изоформ соматотропного гормона, однако различия в их физиологической функции пока не установлены (Baumann, 1999). И температура, и двигательная активность (интенсивность упражнений, чередование уровня нагрузки, продолжительность периодов отдыха) могут влиять на уровень секреции СТГ. Таким образом, его секреция, вероятно, регулируется с участием нескольких путей передачи сигнала, включая разнообразные цепи обратной регуляции, непосредственно на уровне аденогипофиза и/или за счет модуляции гипоталамической секреции соматолиберина или соматостатина. Секреция СТГ имеет отношение к регуляции температуры тела, поскольку дефицит соматотропина снижает потоотделение потовыми железами кожи (Lobie et al., 1990; Borer, 2003), уменьшает теплоотдачу за счет испарения жидкости и повышает риск серьезной гипертермии во время интенсивной двигательной активностью (Hjortskov et al., 1995).
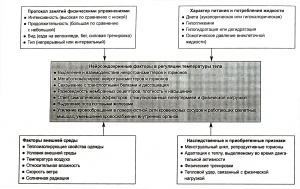
На рис. показана комплексность взаимодействия дополнительных факторов, которые могут влиять на нейроэндокринную регуляцию температуры тела человека во время воздействия теплового стресса и физической нагрузки. Центральная часть этой схемы включает секрецию и клиренс гормонов, их связывание с мембранными рецепторами и связывающими белками и диссоциацию, а также реакцию симпатических эффекторов, которые способствуют рассеянию тепла за счет потоотделения и расширения поверхностных кровеносных сосудов. Эти компоненты нейроэндокринной функции подвергаются воздействию других стимулов, в число которых входят особенности протокола занятий физическими упражнениями, сбалансированность питания, обмена веществ и жидкости, наследственные и приобретенные признаки, а также факторы окружающей среды. Несмотря на то что сегодня практически невозможно дать простого объяснения такой многофакторной проблемы, в следующем подразделе мы рассмотрим наши текущие представления о том, каким образом эти факторы влияют на гормональный ответ на тепловой стресс в сочетании с физической нагрузкой.
Протокол физических упражнений. Исследования Хоффмана указывают на возможность использования норадреналина в качестве предпочтительного гормонального показателя нагрузки на организм человека при одновременном воздействии высоких температур и физической нагрузки (Hoffman et al., 1994). Основой для такого вывода стало отсутствие изменений адреналина, тестостерона и кортизола под влиянием низкоинтенсивной двигательной активности на тредмиле при температуре 33 «С, независимо от исходного состояния гидратации организма или потребления жидкости во время физической нагрузки. Две другие группы исследователей (Mora-Rodriguez et al., 1996; Castellani et al., 1997) также пришли к выводу, что норадреналин является более чувствительным нейроэндокринным маркером, по сравнению с адреналином в условиях низкоинтенсивной двигательной активности при повышенной температуре (33 «С в обоих исследованиях; занятия на велоэргометре 150 и 90 мин с интенсивностью 65 и 50 % V02max соответственно). Выраженные изменения уровня норадреналина при отсутствии колебаний адреналина были показаны для молодых мужчин, занимавшихся в теплоизолирующей одежде (формирование некомпенсируемого теплового стресса) в течение 60 мин на велоэргометре с интенсивностью 50 % V02max при 20 «С (Nybo et al., 2002). Вместе с тем при беге на дистанцию 16,1 км с высокой интенсивностью нагрузки (80 % V02max) на открытом воздухе при температуре 30 *С были обнаружены изменения и норадреналина, и адреналина (Hartung et al., 1987), что свидетельствует о возможности влияния на характер колебаний уровня катехоламинов интенсивности нагрузки или положения тела (вертикальное по сравнению с сидячим), и за счет этого изменения терморегуляции и аккумуляции тепла в организме. В связи с этим возникает вопрос; “Как компоненты протокола занятий физическими упражнениями влияют на нейроэндокринную и терморегуляторную реакцию организма?”
Борер (Borer, 2003) и другие специалисты считают, что гипофизарная секреция АКТГ и β-эндорфина, а также выделение кортизола корой надпочечников и гормонов стресса адреналина и норадреналина мозговым слоем надпочечников возрастает при интенсивности физических нагрузок выше 80 — 90% V02max в умеренных условиях. Вместе с тем в реальности ситуация может оказаться намного сложнее. Концепция Борера явно не учитывает результатов исследований, в которых было установлено: а) отсутствие изменений АКТГ, β-эндорфина и кортизола при трех сверх-максимальиых интенсивностях нагрузки (175, 230 и 318 % V02max; продолжительность 6—46 с; двигательная активность на велоэргометре в положении сидя; 23 ‘С) и повышение уровня этих гормонов при нагрузке 115% V02max (Кгаешег WJ. et al., 1989); б) стабильный уровень β-эндорфина в течение первого часа занятий на велоэргометре (50 % V02max; 35 ‘С) и его увеличение в промежутке между 75 и 120 минутами занятия (Kelso et al., 1984); в) снижение уровня кортизола при выполнении 5 тестов максимальной анаэробной мощности, разделенных на 30 с активного восстановления (при 22 ‘С и 35 ”С) (Hoffman et al., 1997); г) увеличение уровня адреналина, норадреналина и кортизола, сопровождавшее занятие на велоэргометре продолжительностью 120 мин с интенсивностью нагрузки 40 % VO.max (22 °С), с выходом уровня норадреналина на плато в промежутке 60—120 мин (Horton T.J. et al., 1998). Две группы исследователей, проводивших эти эксперименты, пришли к выводу о том, что гормональный ответ не зависит от продолжительности и интенсивности занятий (Kraemer W.J. et al., 1989), а если и зависит, то в большей степени от продолжительности, чем от интенсивности (Hoffman et al., 1997).
Несмотря на сложность интерпретации данных приведенных исследований, их неоднозначность, вероятнее всего, обусловлена различиями в условиях проведения эксперимента. Эту точку зрения подтверждают результаты исследований Кремера (Kraemer W.J. et al., 1995), показавших, что: а) различные протоколы интенсивной силовой тренировки вызывают изменения уровня β-эндорфина и кортизола, которые отличаются по кинетике; б) критическими параметрами протокола занятий оказались длительность интервала приложения силы и продолжительность отдыха между подходами. Исследования, в которых бы предпринималась попытка разделить независимые эффекты вида упражнений (езда на велосипеде, бег, силовые упражнения), типа (непрерывная или интервальная тренировка), интенсивности и продолжительности на гормональную реакцию, практически отсутствуют. Заслуживает внимания одно исследование, в котором была предпринята попытка разделить физиологический ответ на пребывание в условиях с температурой воздуха 23 и 40 ’С от реакции на физическую нагрузку (Brenner et al., 1997). Для полного понимания механизмов нейроэндокринной регуляции температуры тела, а также влияния различных протоколов занятий двигательной активностью требуется проведение значительного количества дополнительных исследований, особенно при температурах внешней среды выше 35 *С.
Диета и гидратация организма. Поскольку изменения уровня гормонов и нейротрансмиттеров могут повлиять па процессы мобилизации или запасания биохимических субстратов, адекватность или недостаточность диеты способна повлиять на нейроэндокринную функцию. Исследования данного вопроса были направлены на анализ значения двух независимых переменных: доступности энергии и состояния гидратации организма.
Во-первых, снижение концентрации глюкозы в крови ( Перспективы дальнейших исследований [ править | править код ]
Нейроэндокринная регуляция температуры тела во время интенсивной двигательной активности в условиях повышенных температур подвергается влиянию многих факторов. К ним относятся взаимодействия между отдельными нейротрансмиттерами и нейропептидами, разнообразные воздействия на функцию гипоталамуса и гипофиза, периодический характер секреции (например, гормона роста) или циркадные ритмы изменений уровня отдельных гормонов (АКТГ, кортизол, СТГ, пролактин), а также механизмы обратной связи и прямого контроля (Veldhius, Yoshida, 2000). Для интерпретации таких сложных взаимодействий, несомненно, необходимы дальнейшие исследования. Учитывая несовершенство современных экспериментальных методов, дальнейшие исследования нейроэндокринного влияния на терморегуляцию во время занятий двигательной активностью о условиях повышенных температур должны развиваться по следующим направлениям:
- Определение различий между центральной (на уровне головного мозга) и периферической (на уровне изменения содержания в крови) реакцией нейроэндокринной системы.
- Изучение индивидуального воздействия предполагаемых нейротрансмиттеров и нейропептидов на различные типы нейронов преоптической области переднего гипоталамуса (а именно, тепло- и холодочув-ствительные).
- Выяснение индивидуальных эффектов на нейроэндокринный ответ различных стрессовых факторов (двигательной активности, интенсивного внешнего теплового воздействия).
- Определение специфических воздействий вида, продолжительности, интенсивности и прерывистого характера двигательной активности на нейроэндокринную реакцию.
- Выяснение направленности долговременных нейроэндокринных адаптаций, происходящих во время тепловой акклиматизации.
- Изучение влияния особенностей питания, включая потребление жидкости на нейроэндокринный ответ.
- Оценка изменений нейроэндокринной функции после теплового удара и теплового истощения, вызванного чрезмерным напряжением, направленная на выявление необратимых изменений.
Читайте также [ править | править код ]
Литература [ править | править код ]
- Adams, W.C, Fox, R.H., Fry, A.J. & MacDonald, I.C. (1975) Thermoregulation during marathon running in cool, moderate and hot environments. Journal of Applied Physiology 38, 1030-1037. Aldercreutz, H., Kuoppasalmi, K., *Kosunen, K., Pakarinen, A. & Karonen, S.L. (1976) Plasma cortisol, growth hormone and prolactin levels during exposure to intense heat. IRCS Medical Science: Endocrine System, Environmental Biology and Medicine 4, 546. *Appenzeller, O., Khogali, М., Carr, D.B. et ah (1986) Makkah hajj: heat stroke and endocrine responses. Annals of Sports Medicine 3, 30-32.
- Armstrong, L.E. & Anderson, J.M. (2003) Heat exhaustion, exercise-associated collapse, and heat syncope. In: Exertional Heat Illnesses (Armstrong, L.E., ed.). Human Kinetics, Champaign, IL: 57-90. Armstrong, L.E. & Maresh, CM. (1991) The induction and decay of heat acclimatization in trained athletes. Sports Medicine 12, 302-312.
- Armstrong, L.E. & Maresh, CM. (1998) Effects of training, environment, and host factors on the sweating response to exercise. International Journal of Sports Medicine 19, S103-S105.
- Armstrong, L.E. & Pandolf, K.B. (1988) Physical training, cardiorespiratory physical fitness and exercise-heat tolerance. In: Human Performance Physiology and Environmental Medicine at Terrestrial Extremes (Pandolf, K.B., Sawka, M.N. & Gonzalez, R.R., eds.). Benchmark Press, Indianapolis, IN: 199-226. Armstrong, L.E. & Stoppani, J. (2002) Central nervous system control of heat acclimation adaptations: an emerging paradigm. Reviews in the Neurosciences 13, 271-285.
- Armstrong, L.E. & VanHeest, J.L. (2002) The unknown mechanism of the overtraining syndrome. Sports Medicine (New Zealand) 32, 185-209.
- Armstrong, L.E., Hubbard, R.W., Jones, B.H. & Daniels, J.T. (1986) Preparing Alberto Salazar for the heat of the 1984 Olympic marathon. Physician and Sports Medicine 14, 73-81.
- Armstrong, L.E., Hubbard, R.W., DeLuca, J.P. & Christensen, E.L. (1987) Heat acclimatization during summer running in the northeastern United States. Medicine and Science in Sports and Exercise 19, 131-136.
- Armstrong, L.E., Hubbard, R.W., Szlyk, P.C, Sils, I.V. & Kraemer, W.J. (1988) Heat intolerance, heat exhaustion monitored: a case report. Aviation Space Environmental Medicine 59, 262-266.
- Armstrong, L.E., Francesconi, R.P., Kraemer, W.J. et al. (1989) Plasma cortisol, renin, and aldosterone during an intense heat acclimation program. International Journal of Sports Medicine 10(1), 38-42.
- Armstrong, L.E., Maresh, CM., Gabaree, CV. et al (1997) Thermal and circulatory responses during exercise: effects of hypohydration, dehydration, and water intake. Journal of Applied Physiology 82, 2028-2035.
- Baumann, G. (1999) Growth hormone heterogeneity in human pituitary and plasma. Hormone Research 51 (suppl. 1), 2-6.
- Bemardes, R.P. & Radomski, M.W. (1998) Growth hormone responses to continuous and intermittent exercise in females under oral contraceptive therapy. European Journal of Applied Physiology 79(1), 24-29.
- Blatteis, CM. (1998) Fever. In: Physiology and Pathophysiology of Temperature Regulation (Blatteis, CM., ed.). World Scientific, River Edge, NJ: 178-205.
- Boisvert, P., Brisson, G.R. & Peronnet, F. (1993) Effect of plasma prolactin on sweat rate and sweat composition during exercise in man. American Journal of Physiology 264, F816-F820.
- Borer. К.Т. (2003) Exercise as an emergency and a stressor. In: Exercise Endocrinology. Human Kinetics, Champaign. IL: 77-95.
- Boulant, J.A. (1996) Hypothalamic neurons controlling body temperature. In: Handbook of Physiology: Section 4. Environmental Physiology (Blatteis, CM. & Fregly, M.J., eds.). Oxford University Press, New York: 105-126.
- Boulant, J.A. & Hardy, J.D. (1974) The effect of spinal and skin temperatures on the firing rate and local thermosensitivity of preoptic neurons. Journal of Physiology 216, 1371-1374.
- Brenner, I.K.M., Zamecnik. J., Shek, P.N. & Shephard. R.J. (1997) The impact of heat exposure and repeated exercise on circulating stress hormones. European Journal of Applied Physiology 76, 445-454.
- Brezenoff, H.E. & Lomax, P. (1970) Temperature changes following microinjection of histamine into the thermoregulatory centers of the rat. Experientia 26, 51-52.
- Casa, D.J. & Armstrong, L.E. (2003) Exertional heatstroke: a medical emergency. In: Exertional Heat Illnesses (Armstrong, L.E., ed.). Human Kinetics, Champaign, IL: 29-56.
- Castellani, J.W., Maresh, CM., Armstrong, L.E. et al. (1997) Intravenous vs. oral rehydration: effects on subsequent exercise-heat stress. Journal of Applied Physiology 82(3), 799-806.
- Chen, X.-M., Hosono, Т., Yoda, Т., Fukuda, Y. & Kanosue, K. (1998) Efferent projection from the preoptic area for the control of non-shivering thermogenesis in rats. Journal of Physiology 512, 883-892.
- Chen, Z.f Yuhanna, I.S., Galcheva-Gargova, Z. et al. (1999) Estrogen receptor a mediates the nongenomic activation of endothelial nitric oxide synthase by estrogen. Journal of Clinical Investigation 103(3), 401-406.
- Christman, J.V. & Gisolfi, C.V. (1980) Effects of repeated heat exposure on hypothalamic sensitivity to norepinephrine. Journal of Applied-Physiology 49(6), 942-945.
- Christman, J.V. & Gisolfi, C.V. (1985) Heat acclimation: role of norepinephrine in the anterior hypothalamus. Journal of Applied Physiology 58(6), 1923-1928.
- Clark, W.G. (1979) Changes in body temperature after administration of amino acids, peptides, dopamine, neuroleptics and related agents. Neuroscience and Biobehavioral Reviews 3, 179-231.
- Clark, W.G. & Fregly, M.J. (1996) Evidence for roles of brain peptides in thermoregulation. In: Handbook of Physiology: Section 4, Environmental Physiology, vol. 1 (Blatteis, CM. & Fregly, M.J., eds.). Oxford University Press, New York: 139-153.
- Clark, W.G. & Upton, J.M. (1986) Changes in body temperature after administration of adrenergic and serotonergic agents and related drugs including antidepressants: II. Neuroscience and Biobehavioral Reviews 10, 153-220.
- Davis, S.N., Galassetti, P., Wasserman, D.H. & Tate, D. (2000) Effects of gender on neuroendocrine and metabolic counterregulato-ry responses to exercise in normal man. Journal of Clinical Endocrinology and Metabolism 85, 224-230.
- DeSouza, E.B. & Appel, N.M. (1991) Distribution of brain and pituitary receptors involved in mediating stress responses. In: Stress-Neurobiology and Neuroendocrinology (Brown, M.R., Koob, G.F. & Rivier, C, eds.). Marcel Dekker, New York: 91-117.
- Eguchi, N., Minami, Т., Shirafuji, N. et al. (1999) Lack of tactile pain (allodynia) in lipocalin-type prostaglandin D synthase-deficient mice. Proceedings of the National Academy of Sciences of the United States of America 96, 726-730.
- Feldberg, W. & Myers, R.D. (1963) A new concept of temperature regulation by amines in the hypothalamus. Nature (London) 200, 13-25.
- Feldberg, W. & Myers, R.D. (1964) Effects on temperature of amines injected into the cerebral ventricles. A new concept of temperature regulation. Journal of Physiology (London) 173, 226-237.
- Follenius, М., Brandenberger, G., Simeoni, M. & Reinhardt, B. (1979) Plasma aldosterone, prolactin, ACTH: relationships in man during heat exposure. Hormone and Metabolic Research 11, 180-181.
- Francesconi, R.P., Sawka, M.N. & Pandolf, K.B. (1984) Hypohydration and acclimation: effects on hormone responses to
exercise /heat stress. Aviation Space and Environmental Medicime 5S, 365-369
Источник