Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
3. Стресс и симпато-адреналовая система
Многочисленными исследованиями установлено, что роль пускового фактора во многих реакциях организма, в ответ на действие разнообразных агентов, играют гормоны мозгового вещества надпочечников, выполняющие одновременно роль медиаторов симпато-адреналовой системы. Экстренное выделение катехоламинов при действии внешних стимулов есть первое проявление стресса.
Согласно представлениям И.П. Павлова, реакция организма на чрезвычайное разражение и возникающие при этом повреждения органов, являются результатом нарушения трофики, вызываемых чрезмерной нервной импульсацией. На основании многочисленных исследований Л.А. Орбели построил теорию об адаптационно-трофической функции симпатической нервной системы. «С одной стороны, она (симпатическая нервная система) изменяет функциональные свойства, адаптация, с другой – вызывает существенные химические, физико-химические и физические сдвиги (трофики)» – Л.А. Орбели (1962).
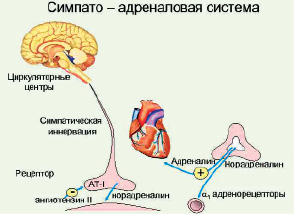
Рис. 8. Симпато-адреналовая система
Целым рядом исследований показано, что возбуждение симпато-адреналовой системы, сопровождаемое мобилизацией катехоламинов, является одной из ранних реакций организма на лучевое воздействие и свидетельствует о пусковой роли гормонов мозгового вещества в реакциях адаптации (В.С. Даниленко и др., 1970, Г.М. Мусагалиева и др., 1988).
Известно (А.М. Бару, 1968,), что увеличение или уменьшение коэффициента А/НА отражает степень активности периферического, либо центрального отдела симпато-адреналовой системы (САС). Установлено, что стресс может привести к нарушениям механизмов адаптационных реакций, к истощению медиаторного звена симпато-адреналовой системы.
Наблюдаемая при стрессе активация симпато-адреналовой системы носит компенсаторный характер и происходит за счет гуморального звена. Повышенная экскреция катехоламинов при стрессе также указывает на значительную активацию симпато-адреналовой системы.
Активация симпато-адреналовой системы при хирургическом стрессе вызывает нарушения гемодинамики, особенно эти нарушения выражены у больных с облитерирующими заболеваниями сосудов, у которых отмечаются снижение сердечного и ударного индексов, повышение общего периферического сопротивления сосудов.
Вместе с тем, активация симпато-адреналовой системы с относительным преобладанием гормонального звена в ближайшем послеоперационном периоде рассматривается как одно из неблагоприятных проявлений постишемического периода.
Длительно существующие высокие концентрации катехоламинов в крови отрицательно влияют на микроструктуру миокарда, вызывают аритмию, резко увеличивают содержание циклических нуклеотидов в клетках сердечной мышцы (Podzweit I. et al., 1981). Ежедневное, в течение 6 недель введение адреналина в дозе 100 мкг/кг веса вызывает изменения обмена веществ и функции органов, характерные для состояния длительной физической тренировки.
Установлено, что токсические дозы катехоламинов могут способствовать развитию аритмий (П.Ф. Литвицкий, 1979), уменьшению эффективности механической работы, повышению потребления кислорода, гипоксемии и развитию феномена «кислородной утечки» (М.Е. Райскина и др., 1963, И.В. Голубева, 1972, Opie L.H. et al., 1979).
Это действие катехоламинов сопровождается сменой прессорных влияний на депрессорные и вызвана стимуляцией бета2-адренорецепторов и может быть предотвращена введением кальция и бета-адреноблокадой (Opie L.H. et al., 1979). Введение токсических доз катехоламинов приводит к некротическим изменениям, воспалению и фибринозному перерождению миокарда (Haft J.I., 1973), нарушению структуры митохондрий (К.С. Митин и др., 1975).
Защитным действием к катехоламиновым некрозам миокарда обладают бета-адренолокаторы (В.В. Малышев и др., 1986 Kulig A. et al., 1973) и антиоксиданты типа витамина Е и этанол. Положительный эффект бета-адреноблокаторов наблюдается и при остром инфаркте миокарда (Edoute Y et al., 1981) и при нейрогенных поражениях миокарда, вызванных трехчасовой электростимуляцией дуги аорты (И.С. Заводская и др., 1977).
Большой цикл исследований по проблеме влияния стресса на кровообращение человека провели P. Obrist (1985) и Е.В. Белова (1987). Согласно этим работам, при стрессе характерно увеличение ЧСС, повышение минутного обьёма кровобращения (МОК) и систолического АД, при отсутствии повышения общего периферического сопротивления сосудов (ОПС), а при корректурной пробе – увеличение ОПС и диастолического АД, без повышения МОК.
В других работах (Б.М. Федоров, 1991) отмечено, что во время стрессового воздействия при напряженной умственной работе показатели кровообращения в различных случаях изменяются не однотипно. В ряде наблюдений вначале отмечается снижение ОПС сосудов и увеличение МОК. По мере нарастания стрессорной реакции характер изменений системной гемодинамики существенно изменялся. При этом снижение тонуса сосудов большого круга кровообращения сменяется его повышением. Соответственно более резко повышается АД и менее значительно повышается или даже снижается МОК.
В стрессорных ситуациях изменяется сердечная деятельность, состояние артериальных и венозных сосудов, микрогемоциркуляция. Учащение сердечных сокращений лишь до определенного предела отражает выраженность стрессорной реакции.
Нарушения кровообращения четко коррелируют с динамикой стрессорных реакций. Влияние стрессов на кровообращение на микроциркуляторном уровне выражается в констрикции артериол, появлением агрегатов эритроцитов, нарушением сосудистой проницаемости, замедлением кровотока в венах, а затем в артериолах, возникновением стазов.
Установлено, что изменения активности симпатической нервной системы, общего периферического сопротивления сосудов и среднего артериального давления в ходе хирургического стресса имеют однонаправленный характер (Т.С. Тапбергенов, 1992).
При психоэмоциональном стрессе отмечено изменение реологических свойств крови, в частности, увеличение ее вязкости и проницаемости стенок венулярных сосудов.
Как показано исследованиями Т.С. Тапбергенова (1992), при хирургическом стрессе степень выраженности изменений показателей вегетативной регуляции и центральной гемодинамики зависят от исходного состояния каждого из них и этапа оперативного вмешательства. При исходно высоком тонусе симпатического отдела вегетативной нервной системы его влияние на среднее артериальное давление и тонус сосудов компенсирует, ожидаемое в начале операции, угнетение сердечно-сосудистой системы, а исходно низкая симпатическая активность вегетативной регуляции усугубляет гемодинамические нарушения в ходе хирургического вмешательства.
В происхождении различных вариантов изменений гемодинамики в стрессорных и экстремальных ситуациях существенное значение имеют изменения венозного возврата крови к сердцу. Так развитие прессорной реакции, вызванной введением катехоламинов, в начальном периоде связано с изменениями тонуса артерий и соответственно повышением общего периферического сопротивления.
При дальнейшем развитии прессорной реакции, вызванной катехоламинами, характерно повышение роли венозного возврата в формировании величины сердечного выброса. Роль этих изменений в поддержании высоких показателей АД становится весьма существенной, составляя до 50 % вклада в реализацию эффекта гипертензии (Б.Я. Зонис, 1986). Давление в венах, состояние окружающих их тканей, в частности скелетных мышц, и особенно симпатическая стимуляция венозного тонуса, чувствительность альфа-адренорецепторов, обеспечивающих констрикторные эффекты – все это отражается на изменении просвета сосудов, емкости венозного русла и возврате крови к сердцу.
Показана возможность в условиях патологии значительного увеличения объёма вен и задержки в них крови при сочетании повышенного давления в растянутых венах с адренергической стимуляцией венозных «сфинктеров», расположенных в области венозных клапанов. При стрессорных воздействиях возникновение коллаптоидных состояний может быть следствием резкого снижения возврата венозной крови к сердцу. Повышение тонуса венозных сосудов и увеличение венозного возврата рассматривается как существенный фактор в патогенезе гипертонии.
Анализ результатов реакции торможения миграции лимфоцитов (РТМЛ) с митогеном конкавалином А (Соn A) в присутствии различных концентраций норадреналина, позволяющей оценить чувствительность адренорецепторов (В.Р. Вебер, 1992), показал, что на разных этапах хирургического стресса имеет место снижение индекса чувствительности адренорецепторов лимфоцитов к норадреналину (табл. 1).
Индекс торможения миграции лимфоцитов при хирургическом стрессе (на 100 клеток, М ± m)
Источник
IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
Стресс — неспецифический ответ организма на любое предъявляемое ему повышенное требование, адаптация к возникшей трудности независимо от ее характера.
Впервые стресс описал в 1936 году канадский физиолог Ганс Селье как общий адаптационный синдром.
Запускать стресс-реакцию могут факторы (стрессоры) разнообразного происхождения (нервное напряжение, телесные повреждения, инфекции, мьппечная работа и др.),
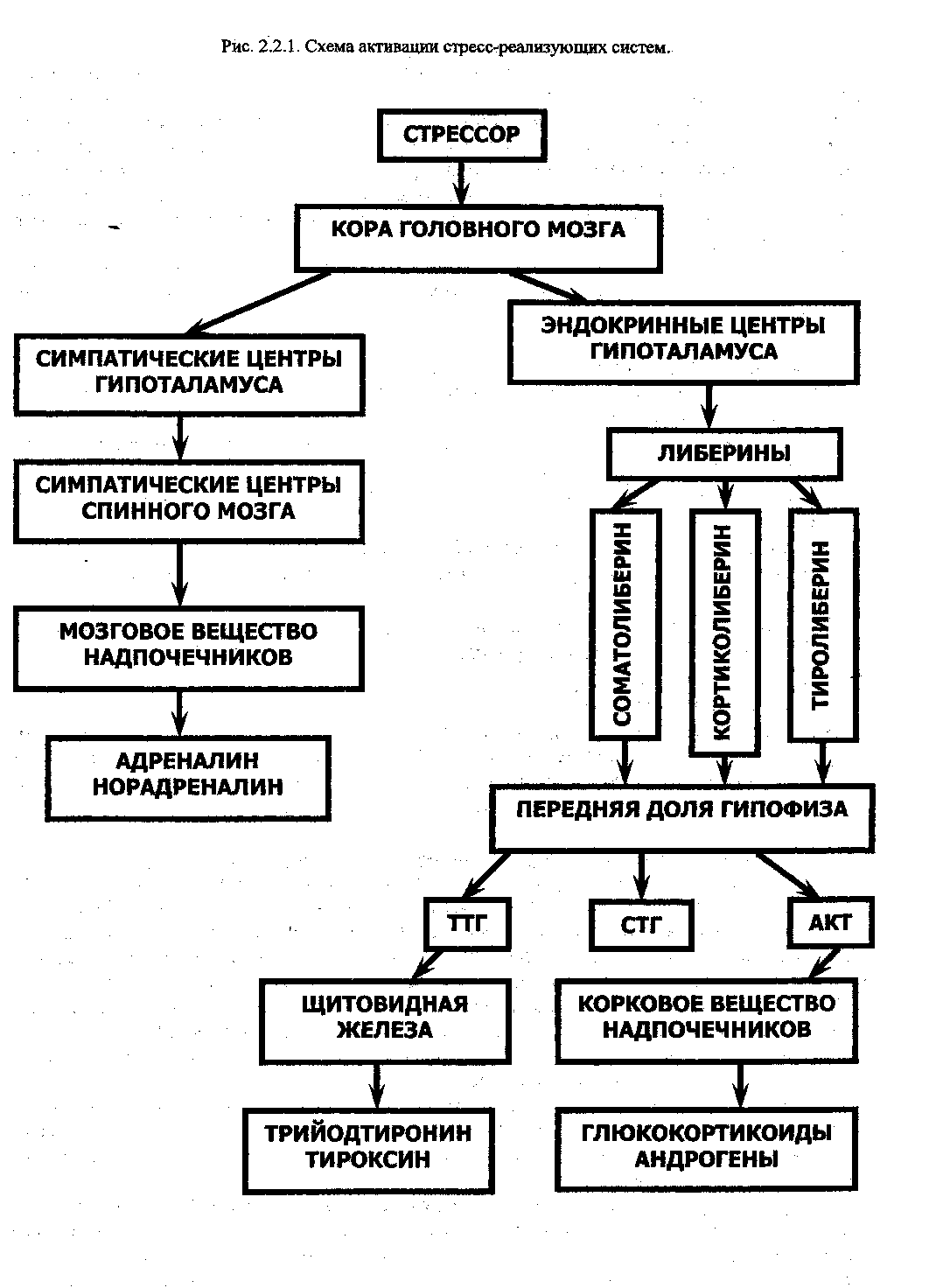
Стресс-реализующими системами являются симпато-адреналовая и гипоталамо-гипофизарно-надпочечниковая система (рис. 2,2.1.).
Воздействие стрессора на организм вызывает формирование очага возбуждения в коре больших полушарий головного мозга, импульсы из которого направляются в вегетативные (симпатические) центры гипоталамуса, а оттуда — в симпатические центры спинного мозга. Аксоны нейронов этих центров идут в составе симпатических волокон к клеткам мозгового вещества надпочечников, формируя на их поверхности холинэргиче-ские синапсы. Выход ацетилхолина в синаптическую щель и взаимодействие его с Н-холинорецепторами клеток мозгового вещества надпочечников стимулирует выброс ими адреналина.
Курение также сопровождается выбросом адреналина, поскольку повышение концентрации никотина в крови приводит к стимуляции Н-холинорецепторов клеток мозгового вещества надпочечников.
Усиление сердечной деятельности, опосредованнное возвуждением (3-адренорецепторов сердца.
Расширение сосудов сердца и мозга, опосредованнное возвуждением (3-адренорецепторов.
Выброс эритроцитов из депо — обусловлен сокращением капсулы селезенки, содержащей а-адренорецепторы.
Лейкоцитоз — «встряхивание» маргинальных лейкоцитов.
Сужение сосудов внутренних органов, опосредованнное возвуждением ос-адренорецепторов.
Расширение бронхов, опосредованнное возвуждением (3-адренорецепторов бронхов.
Угнетение перистальтики желудочно-кишечного тракта (ЖКТ).
Катаболический эффект адреналина обусловлен активацией аденйлатциклазы с образованием цАМФ (циклический аденозинмонофосфат), который активирует протеин-киназы, стимулирующие активность ферментов липолиза, гликогенолиза и тормозящие активность энзимов, участвующих в синтезе гликогена.
Активаиия гипоталамо-гипофизарно-надпочечниковой системы.
Возбуждение участка коры головного мозга под действием стрессора вызывает стимуляцию гипофизотропной зоны медиальной зоны гипоталамуса (эндокринные центры) и высвобождение гипоталамических рилизинг-факторов, которые оказывают стимулирующее действие на аденогипофиз. Результатом этого является образование и выделение тройных гормонов гипофиза, одним из которых является адренокортикотроп-ный гормон (АКТГ). Органом-мишенью этого гормона является корковое вещество надпочечников, в пучковой зоне которого вырабатываются глюкокортикоиды, а в сетчатой зоне— андрогены. Андрогецы вызывают стимуляцию синтеза белка, увеличение полового члена и яичек, ответственны за половое поведение и агрессивность.
Другим тройным гормоном гипофиза является соматотропный гормон (СТГ) к эффектам которого относятся: стимуляция синтеза и секреции инсулиноподобного фактора роста в печени и других органах и тканях, стимуляция липолиза в жировой ткани, стимуляция продукции глюкозы в печени.
Третьим тропным гормоном гипофиза является тиреотропный гормон (ТТГ), который стимулирует синтез тиреоидных гормонов в щитовидной железе. Тиреоидные гормоны ответственны за стимуляцию синтеза белка во всех клетках тела, повышение активности ферментов, участвующих в расщеплении углеводов, разобщении окисления и фосфорилирования (увеличения теплопродукции).
• Индукция синтеза ферментов — глюкокортйкоиды (ГК) проникают через мембрану вцитоплазму клеток, где связываются в комплекс с рецептором (К). Комплекс ГК-К.проникает в ядро, где увеличивает синтез РНК-полимеразы, что ускоряет транскрипцию мРНК, способствуя образованию белков-ферментов глюконеогенеза.
• Мобилизация белковых ресурсов клетки — глюкокортйкоиды освобождают свободныеаминокислоты из мышечной, лимфоидной и соединительной ткани.
• Пермидсивное (разрешающее) действие — особенно четко проявляется в отношениикатехоламинов. Катаболический эффект адреналина обусловлен активацией аденилат-циклазы с образованием цАМФ, который затем активирует протеинкиназы. РаспадцАМФ вызывает фосфодиэстераза, которую ингибируют глюкокортйкоиды, тем самым, усиливая эффекты катехоламинов. Кроме того, глюкокортйкоиды блокируютферменты: моноаминоксидазу (МАО), содержащуюся в адренергических окончаниях,и кагпехол-О-метжгпрансферазу (КОМТ), локализующуюся в цитоплазме эффектор-ных клеток. Эти ферменты вызывают инактивацию катехоламинов.
Увеличение концентрации глюкозы в крови обусловлено усилением глюконеогенеза, торможением синтеза белка, пермиссивным действием глюкокортикоидов на эффект (катаболический) адреналина, снижением проницаемости клеточных мембран для глюкозы.
Мобилизация энергетического ресурса клеток реализуется за счет активации глюко-генеза, торможения синтеза белка, пермиссивного действия глюкокортикоидов по отношению к катехоламинам.
Тормозится воспалительние — глюкокортйкоиды стабилизируют мембраны лизосом и блокируют синтез фосфолипаз, препятствуя тем самым выбросу альтерирующих про-теолитических ферментов, способствуют нормализации повышенной проницаемости сосудов, что уменьшает выраженность экссудации, снижают выделение и синтез медиаторов воспаления, угнетают фагоцитоз.
Снижение иммунитета происходит вследствие торможения синтеза антител (распад белков, репрессия транскрипции), угнетения фагоцитоза.
Источник