- Научная электронная библиотека
- 8. Стресс и метаболические эффекты гормонов-медиаторов симпато-адреналовой системы
- Научная электронная библиотека
- ЗАКЛЮЧЕНИЕ
- IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
8. Стресс и метаболические эффекты гормонов-медиаторов симпато-адреналовой системы
Начиная с исследований Харьковской школы биохимиков и эндокринологов (А.М. Утевский и др., 1939, 1945, 1954, 1959, 1965) научная литература изобилует сообщениями, обзорами, монографиями, посвященных физиологии и биохимии гормонов-медиаторов сипатико-адреналовой системы к которым относятся адреналин, норадреналин и дофамин.
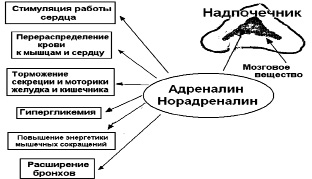
Многочисленными исследованиями показано, что катехоламины как гормоны-медиаторы симпато-адреналовой системы, обеспечивая физиологические эффекты, оказывают регуляторное влияние на углеводный, липидный, азотистый, минеральный и энергетический обмены. Сочетая в себе гормональные и медиаторные функции, они являются «гормонами тревоги», т. е. являются стрессорными гормонами.
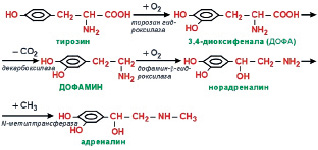
Рис. 10. Синтез катехоламинов
Эти соединения, близкие в химическом отношении и имеющие общих предшественников, в тоже время характеризуются некоторой спецификой в физиологическом действии. Все они имеют отношение к деятельности симпатического отдела вегетативной нервной системы и обладают гормональным и медиаторным действием.
Рис. 11. Функциональные эффекты катехоламинов
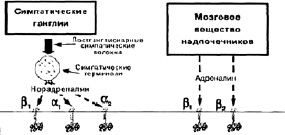
К настоящему времени сложилось вполне обоснованное представление о трансадренорецепторном механизме трансмиссии физиологических и метаболических эффектов катехоламинов. Адренорецепторы являются генетически детерминированными белковыми макромолекулами, локализованными в плазматических мембранах клеток-мишеней (И.В. Комиссаров, 1979). Согласно классификации (Ahlguist R.P. et al., 1966), принятой большинство ученых, различают два вида: альфа- и бета-адренорецепторы.
Рис. 12. Рецепторы катехоламинов
Норадреналин оказывает более сильное, чем адреналин действие на альфа-адренорецепторы и более слабое на бета-адренорецепторы. На основании изучения соотношения активности адреналина и норадреналина в условиях блокирования альфа-адренорецепторов, выделена группа тканей, в которых это соотношение превышает 10. Рецепторы этих тканей предложено относить к бета-бета-типу. Вдругой группе тканей соотношение активностей адреналин/норадреналин меньше 10 и приближается к 1. Рецепторы этих тканей предложено характеризовать как бета-альфа-типа (Grana E. et al., 1974).
Детальный физиологический функциональный и фармакологический анализ позволил И.В. Комиссарову предложить следующую классификацию адренорецепторов и связанные с ними функциональные эффекты катехоламинов:
– альфа-1-рецепторы адренергического возбуждения и сокращения гладких мышц органов;
– альф-2-рецепторы адренергического торможения гладких мышц органов желудочно-кишечного тракта;
– бета-1-рецепторы, опосредующие влияние катехоламинов на сердце, гладкие мышцы желудочно-кишечного тракта и отчасти, обеспечивающие липолитический эффект катехоламинов;
– бета-2-рецепторы, посредством которых осуществляется вазодилятация, понижение тонуса гладких мышц матки и стимулируется гликогенолиз в скелетных мышцах;
– гамма-рецепторы печеночного гликогенолиза и липолиза.
Предложены и другие варианты классификации адренорецепторов (Lefkowits R.J., 1980), где также предусматривается разновидность рецепторов альфа- и бета-типов. Существует мнение о тесной морфофункциональной связи обоих типов адренорецепторов, различия которых обусловлены аллостерическим переходом одной и той же структуры рецептора (Kunоs D. et al., 1976).
Если в вопросах реализации физиологических функций катехоламинов адренорецепторный механизм в какой-то мере удовлетворяет современным представлениям, то в реализации метаболических эффектов существует много неясных вопросов.
Источник
Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
ЗАКЛЮЧЕНИЕ
Анализ результатов исследований позволяет сделать следующее заключение о фунциональных и метаболических эффектах симпато-адреналовой системы и стрессе:
1. Стресс сопровождается возбуждением симпато-адреналовой системы, мобилизацией катехоламинов, обеспечивающих адаптационно – трофические механизмы через биоэнергетику клетки.
2. Активация симпато-адреналовой системы с относительным преобладанием гормонального звена в ближайшем постстрессорном периоде является одним из неблагоприятных проявлений реакции на стресс и выражается в констрикции артериол, появлением агрегатов эритроцитов, нарушением сосудистой проницаемости, замедлением кровотока в венах, а затем в артериолах, возникновением стазов и изменением реологических свойств крови, увеличением вязкости.
3. При стрессе степень выраженности изменений показателей вегетативной регуляции и центральной гемодинамики зависят от исходного состояния. При исходно высоком тонусе симпатического отдела вегетативной нервной системы его влияние на среднее артериальное давление и тонус сосудов компенсирует угнетение сердечно-сосудистой системы, а исходно низкая симпатическая активность вегетативной регуляции усугубляет гемодинамические нарушения.
4. Чрезмерная активация симпато-адреналовой системы вызывает нарушения гемодинамики, отрицательно влияют на микроструктуру миокарда, вызывает аритмию, уменьшает эффективность механической работы, повышает потребление кислорода, приводят к гипоксемии и развитию феномена «кислородной утечки». Это действие катехоламинов может сопровождаться сменой прессорных влияний на депрессорные.
5. Нарушения механизмов адаптационных реакций при стрессе связанны с истощеним медиаторного звена симпато-адреналовой системы. В основе стрессорных поражений лежит резкое снижение обратного захвата катехоламинов, что вначале приводит к длительной адренергической импульсации, вызывающей метаболические сдвиги в энергетическом обмене и в обмене самих гормонов-медиаторов. Это к конце – концов, приводит к истощению их содержания в тканях, к нарушению трофической и адаптационной функции симпато- адреналовой системы.
6. Реализация симпатического сигнала в клетку при нейрогенном стрессе нарушается до аденилатциклазного механизма. Нарушение идет на уровне адренорецепции, на уровне захвата медиатора, а также за счет ускорения моноаминоксидазного пути разрушения катехоламинов, что и приводит к ослаблению адренергической импульсации в органах и в первую очередь в сердечно-сосудистой системе.
7. Метаболизм гормонов-медиаторов симпато-адреналовой системы является регуляторным фактором обмена веществ, процессов трансформации энергии и физиологических функций клеток разных органов. Механизм контроля метаболизма и функций органов и систем может быть понятен только с учетом эффектов метаболитов хиноидного и моноаминоксидазного путей превращения гормонов-медиаторов симпато-адреналовой системой. Факторы, влияющие на метаболизм катехоламинов, изменяют направленность и специфичность физиологических и метаболических эффектов нативных молекул гормонов-медиаторов симпато-адреналовой системы.
8. При нейрогенном и других видах стресса имеет место однонаправленность изменений активности ферментов метаболизма пуриновых нуклеотидов. Наибольшие нарушения происходят в митохондриях, где происходит разобщение окислительного фосфорилирования, снижение синтеза АТФ и креатинфосфата, увеличивается концентрация АДФ, АМФ, аденозина, инозина и гипоксантина, активация ключевого фермента пентозного цикла.
9. При гиперадреналинемии, как показателя активации симпато-адреналовой системы при стрессе, усиливается функциональная взаимосвязь Т- и В-звеньев иммунитета, происходят сдвиги приближенные к состоянию окислительного стресса, что проявляется активацией ГПО, каталазы и ферментов метаболизма пуриновых нуклеотидов АD, АМPD, 5’H, увеличением уровня продуктов перекисного окисления липидов.
10. β1-адреноблокатор метопролол ослабляет выраженность окислительной стрессорной реакции организма животных, вызванную гиперадреналинемией. Для коррекции нарушений функции ферментов антиоксидантной защиты и метаболизма пуриновых нуклеотидов, наблюдаемые при гиперадреналинемии и при окислительном стрессе разного происхождения, можно использовать β1-адреноблокатор метопролол.
11. При симпатической гиперактивации, АМФ и аденозин снижают процессы пероксидации, что проявляется снижением количества МДА и ДК и снижением активности ГР, ГПО и каталазы. АМР и аденозин в отличие от адреналина, не вызывают стрессорной реакции и их действие направлено на сохранение системы антиоксидантной защиты и обеспечения равновесия системы окислительного гомеостаза.
12. Для коррекции изменений в системе антиоксидантной защиты, активности ферментов метаболизма пуринов и иммунных реакций, наблюдаемые при гиперадреналинемии и стрессе любого происхождения, наряду с β-адреноблокаторами можно использовать комплекс АМФ и аденозин.
В хромафинной ткани, в нервном окончании,
В кровеносном русле, жизни начинанье.
Очень важно МАО для аминов обмена,
Но пути другие также несомненны!
КОМТ или хиноны – катехинов путь —
Они вершат законы, становленья суть.
В них природа жизни, наши чувства, знанья,
В них рожденье мысли, сила и желанья!
С ними в ласке губы, с ними зоркость глаз,
С ними в стрессе зубы, в капиллярах стаз!
Это сила жизни, действо митохондрий,
Это кнут ферментов, ломоть хлебосольный!
Хромафинная долина! АТФ-азная трава!
Пусть твои моноамины не иссякнут никогда!
Заслуженный профессор ГМУ г. Семей РК, доктор мед наук, академик РАЕ Тапбергенов Салават Оразович
Источник
IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
Стресс — неспецифический ответ организма на любое предъявляемое ему повышенное требование, адаптация к возникшей трудности независимо от ее характера.
Впервые стресс описал в 1936 году канадский физиолог Ганс Селье как общий адаптационный синдром.
Запускать стресс-реакцию могут факторы (стрессоры) разнообразного происхождения (нервное напряжение, телесные повреждения, инфекции, мьппечная работа и др.),
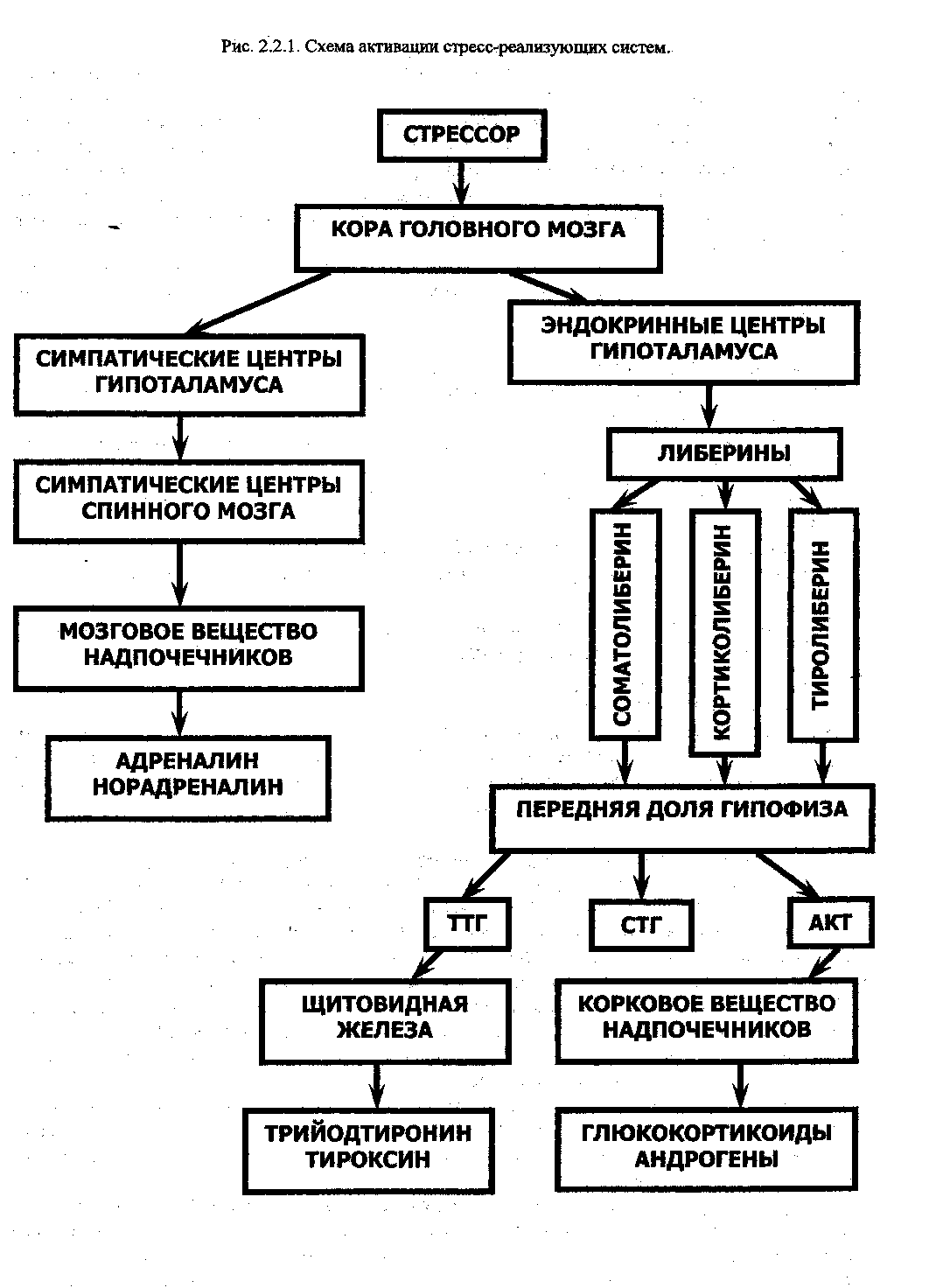
Стресс-реализующими системами являются симпато-адреналовая и гипоталамо-гипофизарно-надпочечниковая система (рис. 2,2.1.).
Воздействие стрессора на организм вызывает формирование очага возбуждения в коре больших полушарий головного мозга, импульсы из которого направляются в вегетативные (симпатические) центры гипоталамуса, а оттуда — в симпатические центры спинного мозга. Аксоны нейронов этих центров идут в составе симпатических волокон к клеткам мозгового вещества надпочечников, формируя на их поверхности холинэргиче-ские синапсы. Выход ацетилхолина в синаптическую щель и взаимодействие его с Н-холинорецепторами клеток мозгового вещества надпочечников стимулирует выброс ими адреналина.
Курение также сопровождается выбросом адреналина, поскольку повышение концентрации никотина в крови приводит к стимуляции Н-холинорецепторов клеток мозгового вещества надпочечников.
Усиление сердечной деятельности, опосредованнное возвуждением (3-адренорецепторов сердца.
Расширение сосудов сердца и мозга, опосредованнное возвуждением (3-адренорецепторов.
Выброс эритроцитов из депо — обусловлен сокращением капсулы селезенки, содержащей а-адренорецепторы.
Лейкоцитоз — «встряхивание» маргинальных лейкоцитов.
Сужение сосудов внутренних органов, опосредованнное возвуждением ос-адренорецепторов.
Расширение бронхов, опосредованнное возвуждением (3-адренорецепторов бронхов.
Угнетение перистальтики желудочно-кишечного тракта (ЖКТ).
Катаболический эффект адреналина обусловлен активацией аденйлатциклазы с образованием цАМФ (циклический аденозинмонофосфат), который активирует протеин-киназы, стимулирующие активность ферментов липолиза, гликогенолиза и тормозящие активность энзимов, участвующих в синтезе гликогена.
Активаиия гипоталамо-гипофизарно-надпочечниковой системы.
Возбуждение участка коры головного мозга под действием стрессора вызывает стимуляцию гипофизотропной зоны медиальной зоны гипоталамуса (эндокринные центры) и высвобождение гипоталамических рилизинг-факторов, которые оказывают стимулирующее действие на аденогипофиз. Результатом этого является образование и выделение тройных гормонов гипофиза, одним из которых является адренокортикотроп-ный гормон (АКТГ). Органом-мишенью этого гормона является корковое вещество надпочечников, в пучковой зоне которого вырабатываются глюкокортикоиды, а в сетчатой зоне— андрогены. Андрогецы вызывают стимуляцию синтеза белка, увеличение полового члена и яичек, ответственны за половое поведение и агрессивность.
Другим тройным гормоном гипофиза является соматотропный гормон (СТГ) к эффектам которого относятся: стимуляция синтеза и секреции инсулиноподобного фактора роста в печени и других органах и тканях, стимуляция липолиза в жировой ткани, стимуляция продукции глюкозы в печени.
Третьим тропным гормоном гипофиза является тиреотропный гормон (ТТГ), который стимулирует синтез тиреоидных гормонов в щитовидной железе. Тиреоидные гормоны ответственны за стимуляцию синтеза белка во всех клетках тела, повышение активности ферментов, участвующих в расщеплении углеводов, разобщении окисления и фосфорилирования (увеличения теплопродукции).
• Индукция синтеза ферментов — глюкокортйкоиды (ГК) проникают через мембрану вцитоплазму клеток, где связываются в комплекс с рецептором (К). Комплекс ГК-К.проникает в ядро, где увеличивает синтез РНК-полимеразы, что ускоряет транскрипцию мРНК, способствуя образованию белков-ферментов глюконеогенеза.
• Мобилизация белковых ресурсов клетки — глюкокортйкоиды освобождают свободныеаминокислоты из мышечной, лимфоидной и соединительной ткани.
• Пермидсивное (разрешающее) действие — особенно четко проявляется в отношениикатехоламинов. Катаболический эффект адреналина обусловлен активацией аденилат-циклазы с образованием цАМФ, который затем активирует протеинкиназы. РаспадцАМФ вызывает фосфодиэстераза, которую ингибируют глюкокортйкоиды, тем самым, усиливая эффекты катехоламинов. Кроме того, глюкокортйкоиды блокируютферменты: моноаминоксидазу (МАО), содержащуюся в адренергических окончаниях,и кагпехол-О-метжгпрансферазу (КОМТ), локализующуюся в цитоплазме эффектор-ных клеток. Эти ферменты вызывают инактивацию катехоламинов.
Увеличение концентрации глюкозы в крови обусловлено усилением глюконеогенеза, торможением синтеза белка, пермиссивным действием глюкокортикоидов на эффект (катаболический) адреналина, снижением проницаемости клеточных мембран для глюкозы.
Мобилизация энергетического ресурса клеток реализуется за счет активации глюко-генеза, торможения синтеза белка, пермиссивного действия глюкокортикоидов по отношению к катехоламинам.
Тормозится воспалительние — глюкокортйкоиды стабилизируют мембраны лизосом и блокируют синтез фосфолипаз, препятствуя тем самым выбросу альтерирующих про-теолитических ферментов, способствуют нормализации повышенной проницаемости сосудов, что уменьшает выраженность экссудации, снижают выделение и синтез медиаторов воспаления, угнетают фагоцитоз.
Снижение иммунитета происходит вследствие торможения синтеза антител (распад белков, репрессия транскрипции), угнетения фагоцитоза.
Источник