Американские ученые доказали пользу грибов при лечении депрессии
Американские ученые провели исследование и установили, что употребление в пищу грибов связано с пониженным риском развития таких состояний психики, как стресс и депрессия. О работе сотрудников Университета Пенсильвании говорится в статье, опубликованной в издании Journal of Affective Disorders.
Специалисты выяснили, что в грибах содержится вещество эрготионеин. Речь идет об антиоксиданте, способном защитить клетки и ткани в организме от повреждений.
Прежде всего речь в работе ученых ведется о белых шампиньонах. Они содержат калий, который снижает беспокойство. Кроме того, некоторые другие виды съедобных грибов, особенно ежовик гребенчатый, могут стимулировать экспрессию нейротрофических факторов (вещества, стимулирующие и поддерживающие развитие нейронов), таких как синтез фактора роста нервов, что может положительно влиять на профилактику нервно-психических расстройств.
«Грибы – это главный источник аминокислоты эрготионеина – противовоспалительного средства, которое не может быть синтезировано организмом. Высокий уровень этого вещества снижает риск окислительного стресса, что также уменьшает симптомы депрессии», – указал один из авторов исследования Джибриль Ба.
Для того чтобы проверить влияние этого фактора, эксперты провели эксперимент, в котором участвовали 24 699 человек, средний возраст которых составил 45,5 лет. Из них испытывали депрессию около 6 % людей. Испытуемых разделили на две группы.
Люди из группу, участники которой употребляли умеренное количество грибов, в среднем оказались меньше подвержены стрессам и депрессиям, чем группа, которая их ела меньше всех. Вместе с тем разница между умеренными потребителями грибов и теми, кто ест их в большом количестве, была незаметна.
Ранее известный миколог Михаил Вишневский рассказал о самых ядовитых грибах, которые можно найти в лесах Европейской России.
Источник
Ученые рассказали о пользе грибов для профилактики рака
Частое употребление грибов связано с более низким риском развития онкологических заболеваний, выяснили специалисты их Университета штата Пенсильвания. Исследование было опубликовано в журнале Advances in Nutrition.
Авторы работы проанализировали 17 посвященных онкологическим заболеваниям работ, опубликованных в 1966-2020 годах, всего в них приняли участие почти 20 тыс. пациентов с разными видами рака. В поисках факторов, которые влияли на вероятность развития онкозаболеваний исследователи обратили внимание на питание.
Оказалось, у тех, кто ежедневно потреблял в пищу хотя бы 18 г грибов, риск развития рака был снижен на 45%.
Исследователи не изучали причины, которые могли бы привести к такому эффекту, но, по всей видимости, дело в эрготионеине — аминокислоте, имеющей антиоксидантные свойства. В человеческий организм она попадает только с пищей. Хотя влияние эрготионеина на организм пока не изучено до конца, в лабораторных условиях он показал способность улавливать гидроксильные радикалы и хлорноватистую кислоту, подавлять выработку оксидантов ионами металлов и участвовать в транспорте ионов металлов и регулировании металлоферментов.
Хотя в шиитаке, грифоле курчавой, вешенках и некоторых других грибах содержится больше эрготионеина, чем в шампиньонах, в целом употребление любых грибов снижало вероятность пострадать от рака.
«Грибы — главный источник эрготионеина в пище, — говорит эпидемиолог Джибрил Ба, один из авторов работы. — Эрготионеин — уникальный и мощный антиоксидант, защищающий клетки. Присутствие антиоксидантов в организме способно защитить от окислительного стресса и снизить риск развития рака».
Наиболее выраженную связь исследователи обнаружили с раком молочной железы.
Однако это могло быть связано с тем, что в большинстве работ именно ему уделялось больше всего внимания. В дальнейшем ученые надеются узнать больше о влиянии грибов в рационе на риски развития рака и, возможно, найти способ сформировать более полные диетологические рекомендации, направленные на снижение рисков.
«В целом, эти результаты — важное доказательство защитного действия грибов, — говорит фармаколог Джон Ричи, соавтор исследования. — Для более точного определения соответствующих механизмов и конкретных видов рака, от которых они защищают, необходимы дальнейшие исследования».
О пользе грибов врачи и ученые говорят давно. В них содержатся белок, витамины группы В и С, никотиновая и фолиевая кислоты, кальций, фосфор, калий, железо. Все эти элементы положительно влияют на работу сердечно-сосудистой и центральной нервной системы, укрепляют костную ткань и благотворно воздействуют на кроветворение, уточнила диетолог. При этом в грибах, как в продукте растительного происхождения, нет холестерина.
Также грибы могут быть полезны людям с сахарным диабетом, потому что углеводы в них представлены пищевыми волокнами, что способствует снижению уровня глюкозы в крови.
Около 150 грамм грибов можно употреблять каждый день без вреда для здоровья,
отметила ранее врач-диетолог клиники лечебного питания ФГБУН «ФИЦ питания и биотехнологии», кандидат медицинских наук Елена Ливанцова.
«Разовая порция составляет 120-150 граммов. Если нет заболеваний, которые ограничивают потребление грибов, то в принципе каждый день можно потреблять грибы без вреда для здоровья», — сказала она.
К таким заболеваниям относятся болезни желудочно-кишечного тракта в фазе обострения -– гастриты, язвенная болезнь, колиты, панкреатит, а также почечная и печеночная недостаточность.
Стоит иметь в виду, что польза грибов зависит от того, где они растут — ни в коем случае нельзя употреблять грибы, которые собраны на участках, прилегающих к автотрассам. Грибы, как губка, собирают те вещества, которые находятся в почве, поэтому в их составе могут оказаться токсины и тяжелые металлы.
Лучше употреблять грибы, выращенные в агрокультурных хозяйствах.
При этом врачи сходятся во мнении, что грибы не следует употреблять в сыром виде. По словам Ливанцовой, оптимальный вариант – грибы, жаренные без масла. Считается, что полезные свойства максимально сохраняются при готовке на гриле, потому что это более кратковременный процесс, в отличие от варки.
Источник
Окислительный стресс у грибов
В живых системах существуют два основных типа использования кислорода клеткой (два пути окисления): оксидазный и оксигеназный. В первом случае в результате последовательных реакций ферментативного дегидрирования углеводов и жиров и последующего транспорта электронов в митохондриях на конечном пункте этого транспорта – ферменте цитохромоксидазе – происходит 4-электронное восстановление кислорода с образованием воды. Таким образом, в клетке синтезируется АТФ, а также вода и углекислота. Оксидазный путь не предусматривает включения кислорода в молекулу окисляемого субстрата.
Наряду с этим в клетках протекают реакции прямого присоединения кислорода к органическим веществам (оксигеназный путь). В оксигеназных реакциях полного 4-электронного восстановления кислорода не происходит, а наблюдается в основном неполное одноэлектронное его восстановление. Появление неспаренного электрона в молекуле кислорода придает ей свойства свободного (активного) радикала.
Окислительному стрессу подвержены все организмы с аэробным дыханием, поскольку активные формы кислорода (АФК) образуются вследствие нормального метаболизма. Большинство АФК, такие как пероксид водорода, супероксидный и гидроксильный радикалы, являются побочными продуктами в электронно-транспортной цепи в процессе окислительного фосфолирирования. В метаболических путях у E. coli встречается два пути расщепления перекиси водорода – с образованием кислорода и воды; окисление L-аскорбата до L-дегидроаскорбата. Помимо участия в метаболических путях, перекись водорода участвует в реакциях окислениях и реакциях Фентона, происходящих в клетках E. coli.
Развитие окислительного стресса в бактериях вовлекает в работу два ключевых регулона, контролируемые транскрипционными активаторами soxR и oxyR. Белки, экспрессия которых индуцируется системой SoxRS, действуют совместно и устраняют возможный ущерб от оксидативного стресса, используя механизмы удаления оксидантов (супероксид дисмутаза), репарацию ДНК (эндонуклеаза IV), восстановление окисленных металлов в проcтетических группах (флаводоксин и ферредоксин редуктаза) и системы НАДФН (глюкозо-6-фосфат дегидрогеназа), снижение проницаемости (micF) и экскрецию токсинов (порины). Активация генов регулона SoxRS увеличивает устойчивость клетки не только к супер-оксид генерирующим агентам, но и к органическим растворителям, а также оксиду азота (NO), который может генерироваться антибиотиками [1].
Особую группу веществ, способных оказывать значительное влияние на рост и жизнедеятельность бактерий, составляют антибиотики. Они представляют собой весьма разнородную группу химических соединений, впервые полученных у низших грибов, и в дальнейшем созданных синтетических аналогов. В большинстве случаев, антибиотики действуют на структурные компоненты бактериальных клеток, не затрагивая эукариотические клетки макроорганизма, в связи с чем данные препараты получили широкое распространение в медицине и ветеринарии.
Механизм действия антибиотиков различен для отдельных групп данных лекарственных средств, при этом одни обладают бактерицидным действием, что сопровождается нарушением структурной целостности клетки или значительным изменением обмена веществ у микроорганизмов, что приводит к их гибели. С другой стороны, существуют препараты, блокирующие процесс размножения бактерий, в результате чего их количество постепенно снижается из-за невозможности генераций. Это бактериостатический механизм действия антибиотиков. Точки приложения антибактериальных средств также различаются для каждой группы представителей, что дает возможность выбрать подходящий антибиотик для конкретного пациента. Основными точками воздействия антибиотиков на бактериальную клетку являются: нарушение синтеза клеточной стенки, нарушение синтеза различных белков, действие на синтез нуклеиновых кислот, входящих в состав ДНК микроорганизмов, действие на мембрану клетки [2].
Тем не менее, некоторыми исследователями было обнаружено, что некоторые антибиотики способны вызывать окислительный стресс у бактериальных клеток, что, наряду с прямым антимикробным действием препарата, усиливает бактерицидный эффект. Окислительный стресс происходит в клетках микроорганизмов под воздействием бактерицидных антибиотиков, при котором клетки производят молекулы химически реактивного кислорода, вызывающие повреждение ДНК и ферменты бактерий, а также мембрану, которая охватывает клетку.
Было установлено, что антибиотики действуют через АФК-зависимый (АФК – активные формы кислорода) механизм, в конечном итоге производящий гидроксильный радикал. Производство АФК является результатом всплеска клеточного дыхания, в результате экспозиции с антибиотиком сопровождающимся генерацией супероксид аниона. Это ведет к разрушению железо-серных кластеров и в присутствии ионов железа (II), с участием пероксида водорода ведёт к образованию гидроксильного радикала через реакцию Фентона, способного вызывать повреждения и гибель клетки. Было показано, что воздействие спектиномицина, хлорамфеникола, рифампицина вело к гибели клеток, однако при избыточной экспрессии каталазы или супероксиддисмутазы, а также в случае добавления экзогенных ферментов, снижало бактерицидную активность данных антибиотиков. Так же было показано, что в окислительный стресс, при воздействии аминогликозидов, вовлекаются оба регулона (soxRS и oxyR) и штаммы, имеющие мутации по каталазе и супероксиддисмутазе оказываются менее жизнеспособными по сравнению с дикими типами [3].
Таким образом, исследование механизмов действия антибиотиков через индукцию окислительного стресса в клетках открывает их новые, ранее не известные свойства, которые могут оказывать воздействие на клетки организма хозяина. Одним из подходов, по решению данного вопроса является использование как клеточных систем, способных детектировать развитие окислительного стресса, так и параллельная оценка с использованием безклеточных комплексов, основанных на окислении хромогенов и люминофоров.
Источник
Окислительный стресс у грибов
Тяжёлые металлы – широко распространённые экотоксиканты, потенциально опасные для всех живых организмов. Одной из причин токсических эффектов тяжёлых металлов является индуцированный ими окислительный стресс – процесс повреждения клеток организма в результате окислительных реакций [9]. Ионы свинца, кадмия, кобальта и других тяжёлых металлов способны инициировать генерацию избыточного количества активных форм кислорода (АФК) [5–6, 9]. Повышенный уровень АФК в клетке способствует запуску цепных реакций окислительной деградации биомолекул, в частности, инициируют перекисное окисление липидов (ПОЛ) клеточных мембран, что способствует нарушению их структуры и повышению проницаемости. В клетке существуют специализированные ферментные и неферментные антиоксидантные системы защиты от свободных радикалов [5]. Определение веществ, чье действие направлено на нормализацию метаболических процессов, на блокаду патологических свободно-радикальных процессов, является важным звеном в исследованиях механизмов адаптации организмов к воздействию токсикантов. Хорошо известно, что аскорбиновая кислота способна реагировать с супероксидным и гидроксильным радикалами и тем самым снижать их концентрацию в клетке, препятствуя развитию оксидантного стресса [4]. В частности, в опытах на крысах аскорбиновая кислота оказывала протекторное антиоксидантное действие при формировании условных реакций в условиях токсического действия солей тяжёлых металлов (Со, Рb и Cd) и нейротропного препарата пирацетама [1–3]. Было установлено, что каталитическое действие солей тяжелых металлов влияет на структурные характеристики пирацетама, и, как следствие, искажает его лечебный эффект [3, 8]. In vitro показано, что аскорбиновая кислота предотвращает взаимодействие солей тяжёлых металлов со структурой лекарственного препарата [2].
В основе комплекса ответных реакций организма, имеющих защитный характер и обеспечивающих адаптацию к меняющимся условиям в ответ на воздействие различных неблагоприятных факторов, в том числе и токсических агентов, лежат единые фундаментальные механизмы. Одноклеточные инфузории имеют относительно их размеров большую поверхность соприкосновения с внешней средой, сразу же вступают в контакт с токсикантом, реагируя на химическое действие целым комплексом биологических, физиологических и биохимических изменений: хемотаксисом, реверсией ресничной активности, скоростью размножения. Многие гидробионты к тому же обладают фильтрационным типом питания, что повышает вероятность накопления ими веществ-токсикантов и повышает эффект их воздействия на организм.
Цель данной работы – исследование влияния токсических веществ – индукторов оксидантного стресса и защитного действия антиоксидантных соединений на клетку – организм Paramecium caudatum.
Материалы и методы исследования
Культуру клеток Paramecium caudatum (дикий штамм) выращивали на среде Лозина–Лозинского, с добавлением дрожжей питательной среды, содержащей дрожжи Saccharomyces cerevisiae. Для индукции окислительного стресса использовались соли тяжёлых металлов: хлорид кадмия, ацетат свинца и для сравнения перекись водорода (Н2О2). Чувствительность инфузорий к токсичным веществам определяли по времени их гибели, которую фиксировали по прекращению движения простейших, часто сопровождающемуся деформацией и лизисом клетки. Время экспозиции составило 2 часа. Число клеток в 10 мл среды, содержащей интактную культуру инфузорий (без индукции окислительного стресса), служило контролем во всех опытах. Подсчет общего количества клеток в 10 мл среды, содержащей инфузории, определяли в счетной камере Горяева. Клетки, взятые в стационарной фазе роста, инкубировались при температуре 20 ± 2 °С в среде с добавлением химического вещества в течение 15 суток (хронический опыт). Действие токсических веществ исследовалось в нескольких концентрациях (0,05; 0,025; 0,005; 0,0025; 0,00125 мг/л); влияние веществ с антиоксидантными свойствами (аскорбиновая кислота, пирацетам) исследовались при концентрациях 1, 10, 50 мкМ и 1 мМ.
Результаты исследования и их обсуждение
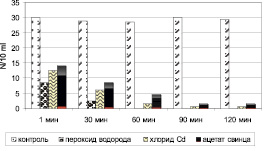
В проведённых экспериментах установлено, что хлорид кадмия и ацетат свинца (0,05 мг/л) в первые 30 мин инкубирования вызывали мгновенную остановку движения инфузорий. Внесение в среду с инфузориями перекиси водорода (0,05 мг/л) привело к тому, что в первую минуту опыта число особей уменьшилось в 3 раза по сравнению с контролем. Микроскопические исследования показали многочисленные грубые морфологические изменения клеток инфузорий от воздействия Н2О2, в том числе структурные нарушения мембран и цилиарные аномалии («вакуолизация» клеточной стенки), которые приводили к гибели микроорганизма. Снижение численности опытных клеток в результате деструктивной мембранной патологии свидетельствовали об интенсификации процессов свободно-радикального окисления. 100 % смертность инфузорий от действия перекиси водорода отмечено к 60 мин опыта. В контроле число особей не изменяется на протяжении всего опыта (рис. 1). Токсическое действие солей тяжёлых металлов было менее выраженным.
Рис. 1. Токсическое действие химических веществ на культуру клеток Paramecium caudatum (по абсциссе – длительность опыта; по ординате: N ‒ число особей в 10 мл опытной среды)
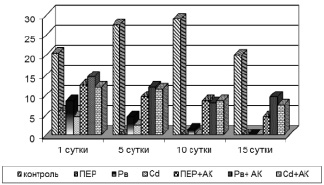
Задачей следующего опыта являлось изучение влияния перекиси водорода и солей тяжёлых металлов на воспроизведение клеток парамеций. Поскольку при концентрациях 0,05 и 0,025 мг/л отмечалась гибель культуры клеток, для исследования воспроизведения клеток концентрации токсических веществ были уменьшены в 20 раз. При этой концентрации в первые сутки опыта (рис. 2) выживала значительная часть клеток. При инкубировании клеток в течение 15 суток установлено, что наиболее токсичными оказались среды с содержанием пероксида водорода и хлорида кадмия, в которых инфузории не воспроизвели даже первого поколения (рис. 2).
Рис. 2. Динамика роста популяции Paramecium caudatum в среде с содержанием различных химических веществ: контроль – физ. раствор; ПЕР – пероксид водорода; Рв – диацетат свинца; АК – аскорбиновая кислота
Добавление аскорбиновой кислоты (1 мМ) в среду с клетками, подвергшимися действию перекиси водорода, увеличило в первые сутки число особей почти вдвое. К 5 суткам инфузории, которые инкубировались в среде с перекисью водорода, погибли. В то же время аскорбиновая кислота предотвратила гибель культуры клеток, что отмечалось во все опытные дни (рис. 2, 3).
В среде с добавлением соли тяжёлого металла 100 % смертность культуры зафиксирована на 15 сутки.
При добавлении аскорбиновой кислоты в культуре клеток, ацетата свинца, к 15-м суткам отмечалось незначительное снижение числа особей. Таким образом, аскорбиновая кислота проявила аналогичную антиоксидантную активность, что и против перекиси водорода.
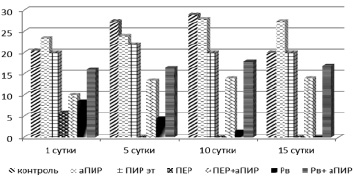
Для доказательства эффективности антиоксидантного соединений с механизмом действия, отличным от аскорбиновой кислоты, мы исследовали Paramecium caudatum в среде с добавлением пирацетама – соединения с неспецифической антиоксидантной активностью [3, 7] (рис. 3).
Рис. 3. Динамика роста популяции Paramecium caudatum в среде с содержанием различных химических веществ: контроль – физ. раствор; ПЕР – пероксид водорода; Рв – диацетат свинца; ПИР эт – раствор пирацетама (лекарственная форма); аПИР – раствор структурно-модифицированного пирацетама
В наших опытах мы исследовали эффективность лекарственной формы пирацетама (ПИР эт) и её структурно-модифицированной формы (аПИР). Оба вещества предотвратили гибель клеток инфузорий от действия перекиси водорода и соли тяжёлого металла. Антиоксидантный эффект пирацетама был менее выражен по сравнению с защитным действием аскорбиновой кислоты. Тем не менее к 15-м суткам выживаемость особей при внесении в среду с инфузориями аПИР составила 100 %.
Проведённые эксперименты свидетельствуют о высокой чувствительности одноклеточных микроорганизмов к действию таких распространённых экотоксикантов, как соли кадмия и свинца, что позволяет использовать инфузории в биотестах для оценки токсичности сред, содержащих тяжёлые металлы. Как известно, антиоксидантная система организма многокомпонентна, она способна предотвращать образование активных форм кислорода и разрушать как свободные радикалы, так и первичные и вторичные продукты реакций перекисного окисления липидов (ПОЛ). В данной работе аскорбиновая кислота и структурно-модифицированный нейротропный препарат – пирацетам ‒ оказались эффективными протекторами от возникших под воздействием солей тяжёлых металлов и перекиси водорода процессов ПОЛ у одноклеточных организмов.
Рецензенты:
Заиков Г.Е., д.х.н., профессор, руководитель отдела биологической и химической физики полимеров Институт биохимической физики им. Н.М. Эмануэля РАН, г. Москва;
Зорина З.А., д.б.н., профессор, заведующая лабораторией и генетики поведения, биологический факультет МГУ им. М.В. Ломоносова, г. Москва.
Источник