Новорожденный ребенок чувствует боль
Проблемы клинической оценки боли у новорожденных детей
Сотрудники «Ивановского НИИ материнства и детства им. В.Н. Городкова» совместно с «Калужской областной клинической больницой», в своей статье освятили ключевые положения, касающиеся оценки боли у новорожденных детей, ее прогностического значения и инструментов для правильной оценки степени выраженности боли у ребенка.
На протяжении многих лет в неонатологии существовало ошибочное представление о том, что новорожденные дети не чувствуют боль так же остро, как взрослые, и, как следствие, лечение боли в неонатальной практике и оценка ее отдаленных исходов долгое время не получали должного внимания. При этом боль, особенно у глубоконедоношенных детей, может способствовать нарушению развития головного мозга. Данное обстоятельство было продемонстрировано в одном из исследований, посвященных боли у новорожденных детей (86 недоношенных до 32 нед гестационного возраста), в котором проводилась 3D-магнитно-резонансная спектроскопия головного мозга с определением соотношения N-ацетиласпартат/холин, лактат/холин и исследованием фракционной анизотропии 7 участков белого вещества и 4 участков подкоркового серого вещества головного мозга. Оказалось, что моторное развитие детей в 8 мес постконцептуального возраста было хуже в случае наибольшего числа эпизодов повреждения кожи как маркера боли.
Объективная оценка боли у новорожденных детей сопряжена с трудностями, связанными с возрастными особенностями и невозможностью пациентом самостоятельно указать на существующую проблему.
В качестве определения «боли» у новорожденных детей в 1979 г. Международная ассоциация по исследованию боли (International Association for the Study of Pain, IASP) рассматривала «любое неприятное сенсорное и/или эмоциональное ощущение, сопровождающееся фактическим или потенциальным повреждением тканей». Выделяют несколько типов боли у новорожденных детей: острую (включает и процедурную, и послеоперационную), длительную боль и хроническую. Острая боль должна рассматриваться как обширно и непрерывно воздействующий болевой и поведенческий процесс, который вызывается повреждением тканей в организме.
Длительная боль отличается от хронической тем, что существует явный стимул при ее возникновении, вызванный наличием определенной патологии/болезни (например, перитонит) или проводимой терапией (например, механическая вентиляция легких, интубация трахеи или установка дренажей). Длительная боль к настоящему моменту плохо изучена, но, как правило, имеет четкое время начала и ожидаемое время завершения (менее 3 мес до полного восстановления поврежденных тканей, в отличиетот хронической боли). Кроме того, данный вид боли может возникнуть после нескольких дней госпитализации новорожденного ребенка в отсутствие явной причины.
Принято выделять термины, в той или иной степени связанные с понятием боли:
– страдание – эмоциональная реакция организма на боль;
– болевое поведение – специфическое поведение субъекта (больного), позволяющее окружающим (врачу) заключить, что он испытывает боль. Боль всегда субъективна несмотря на объективность ее существования;
– демонстрация боли – если человек страдает от боли, он всегда это демонстрирует либо окружающим, либо себе;
– стресс – адаптивная физиологическая реакция организма на определенные внешние стимулы. При этом у новорожденных нет осознания наличия стресса и, следовательно, возможно, нет связанного с ним страдания;
– дистресс, не связанный с болью – реакция организма на внутренние и внешние раздражители, которая может включать дискомфорт, беспокойство и страх;
– оптимальная седация – состояние, при котором пациент находится в состоянии сонливости, реагирует на различные факторы окружающей среды, но при клиническом осмотре не испытывает беспокойства; кроме того, у него отсутствуют чрезмерные движения;
– синдром ятрогенной абстиненции – клинический синдром, проявляющийся после прекращения или отмены лекарственного вещества, которое применялось в течение длительного периода.
Причины, особенности восприятия боли и ее клинические проявления у новорожденных детей.
Крайне важно правильно понимать, какие именно обстоятельства и причины вызывают развитие болевого синдрома у новорожденного ребенка. Стоит отметить, что любая хирургическая манипуляция и послеоперационный период сопровождаются болью у новорожденных.
Причины возможного болевого синдрома/дистресса у новорожденных: искусственная вентиляция легких (ИВЛ); повторные болезненные инвазивные процедуры; малые хирургические процедуры (установка плеврального дренажа; надлобковая пункция с целью аспирации мочи; люмбальная пункция; установка вентрикуло-перитониального дренажа и др); сопутствующие инфекционные/воспалительные заболевания (некротизирующий энтероколит, остеомиелит, менингит, генерализованный сепсиc); осложнения необходимых процедур (флегмона или абсцесс от внутривенной инфузии, пролежни); послеоперационный период после обширного оперативного вмешательства; боль, вызванная проведением диагностических процедур и общего ухода; боль, вызванная агрессивными факторами окружающей среды; физиологический стресс.
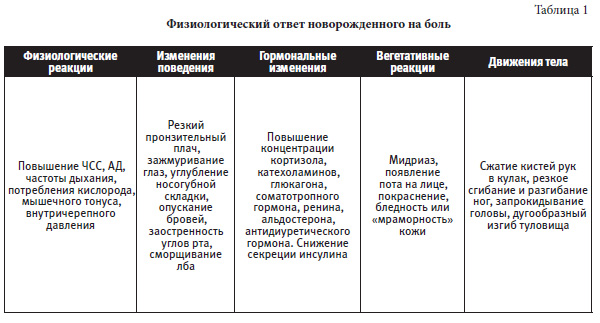
Новорожденные дети чувствуют боль, но они не способны ее осознавать, имеют низкий порог боли, могут запоминать ее в виде вторичной гипералгезии (сенситизация рецепторов), часто не локализуют боль, проявляя диффузный ответ на боль. Недоношенные дети внешне демонстрируют реакцию на боль слабее, но имеют более генерализованный характер боли из-за широких рецепторных полей и их перехлеста. Внешне боль у новорожденных детей выражается психоэмоциональными (плач, мимика), физиологическими (тахикардия, тахипноэ, снижение оксигенации, потливость, гиперемия, бледность, мидриаз), нейроэндокринными (повышение уровня катехоламинов, кортизола, снижение секреции инсулина, как следствие стресса) проявлениями.
Показатели болевого синдрома/дистресса:
- Поведенческие реакции: слышимый крик (не применяется у детей с установленной эндотрахеальной трубкой); выражение лица (характерная выпуклость бровей, зажмуривание глаз, выраженность носогубной складки, дрожь подбородка и др.); отдергивание конечности в ответ на болевой раздражитель; изменения в положении тела (общее повышение активности, сгибание верхних и нижних конечностей, выгибание, разгибание ног, разведение пальцев или сжатие кистей в кулак); нарушения цикла сна, сопровождающиеся подергиваниями, рывками, нерегулярным дыханием, гримасами или всхлипыванием; поведение, направленное на самоуспокоение, такое как изменение положения тела, движения рук ко рту, сосание, сосредоточенность.
- Физиологические реакции: увеличение частоты сердечных сокращений; повышение артериального давления; изменение частоты дыхания; нарушения оксигенации; изменения цвета и температуры кожных покровов; увеличение потливости ладоней (применимо у детей с гестационным возрастом >37 нед); изменение мозгового кровотока и внутричерепного давления; желудочно-кишечные расстройства.
Шкалы оценки боли у новорожденных детей
Объективная оценка наличия и степени выраженности боли у новорожденного ребенка и своевременность действий, направленных на ее купирование, зависят в первую очередь от адекватного восприятия ситуации врачом. Так, B.J. Taylor и соавт. (2006) исследовали 250 новорожденных детей в 10 ОРИТН США, где с помощью 7 различных оценочных шкал боли в течение 72 ч анализировалась эффективность послеоперационного обезболивания (оценку проводили раз в 4–12 ч). Оценка степени тяжести болевого синдрома была документально зафиксирована медицинскими сестрами и врачами. Выявлено, что на обезболивающую терапию объективно влияла только оценка тяжести боли врачом. С целью оптимизации оценки боли у новорожденных детей профильными специалистами во всем мире было разработано более 40 доступных для клинического применения инструментов, однако ни один из них, к сожалению, в настоящее время не является «золотым стандартом». Данная ситуация связана с тем, что у обсуждаемых инструментов/шкал есть немало ограничений. Прежде всего на адекватную оценку боли влияет гестационный возраст новорожденного ребенка, так как уровень боли зависит от того, насколько успела сформироваться нервная система к моменту рождения. Уровень возбуждения ребенка в момент осмотра также играет большую роль в определении боли. Тяжесть основного заболевания, а также наличие у пациента различного рода медицинских устройств, трубок, протезов и т.д. зачастую могут скрывать специфические признаки и проявления боли. Например, у детей с установленной эндотрахеальной трубкой крик, оцениваемый во многих шкалах, слышен не будет. Наличие и фиксация эндотрахеальной трубки или устройств для неинвазивной респираторной поддержки будут изменять выражение лица пациента. «Гнездо», наличие датчиков мониторинга витальных функций, сосудистые доступы могут придавать определенное вынужденное, фиксированное положение, что ведет к ограничению движений пациента.
Оценка по шкалам боли не должна производиться у новорожденных детей с тяжелой неврологической патологией. В таких случаях ориентиром для оценки уровня боли будут служить в большей степени частота сердечных сокращений (ЧСС), уровень артериального давления, цвет, температура и влажность кожных покровов. В ряде шкал с целью оптимизации понимания выраженности боли вместе с поведенческими реакциями оцениваются объективные показатели состояния новорожденного ребенка. Перспективным методом оценки уровня боли также является изучение вариабельности ритма сердца, основанное на анализе колебаний длительности интервалов R–R на ЭКГ. Однако в рамках данной статьи мы обратим внимание лишь на клинические признаки, которые были положены в основу самых распространенноых и доступных шкал оценки боли у новорожденных детей, сочетающих в себе оценку как физиологических, так и поведенческих реакций.
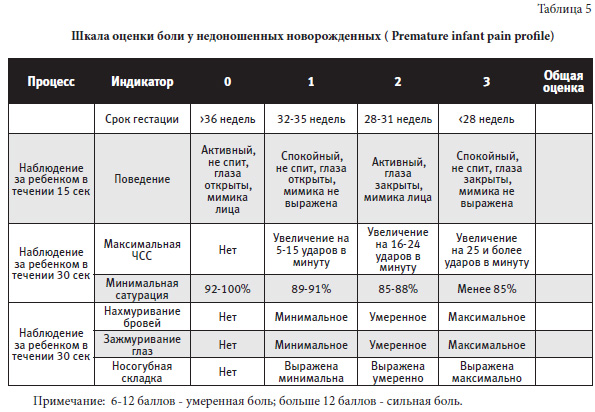
Шкала PIPP (Premature Infant Pain Profile, профиль боли у недоношенных детей). С помощью данной шкалы оцениваются гестационный возраст, поведенческое состояние ребенка и изменения физиологических показателей в зависимости от воздействия болевого раздражителя. Сначала необходимо провести первичную оценку по шкале до воздействия болевого раздражителя, чтобы объективизировать изменение показателей в ответ на боль. Параметры ЧСС и уровень насыщения крови кислородом (SpO2) оцениваются за 15 с до болевого раздражителя и через 15 с после его воздействия. Зажмуривание глаз, положение бровей и выраженность носогубной складки оцениваются визуально (в течение 30 с после болевого воздействия). Для точной оценки необходимо соблюдать одинаковые временные промежутки, в течение которых ребенок будет «демонстрировать» определенные признаки. Результаты, полученные после суммирования баллов, варьируют от 0 до 21. Суммарная оценка ≤ 6 баллов указывает на отсутствие боли или минимальную боль; от 7 до 12 баллов – на умеренную боль, более 12 баллов – на сильную боль.
Шкала N—PASS (Neonatal Pain, Agitation, and Sedation Scale, шкала оценки боли, возбуждения и седации). Шкала оценки боли, возбуждения и седации у новорожденных детей может быть использована для определения уровня боли как у доношенных, так и у недоношенных новорожденных, которые испытывают длительную послеоперационную боль и/или боль во время ИВЛ. В шкале оценивается пять физиологических и поведенческих показателей.
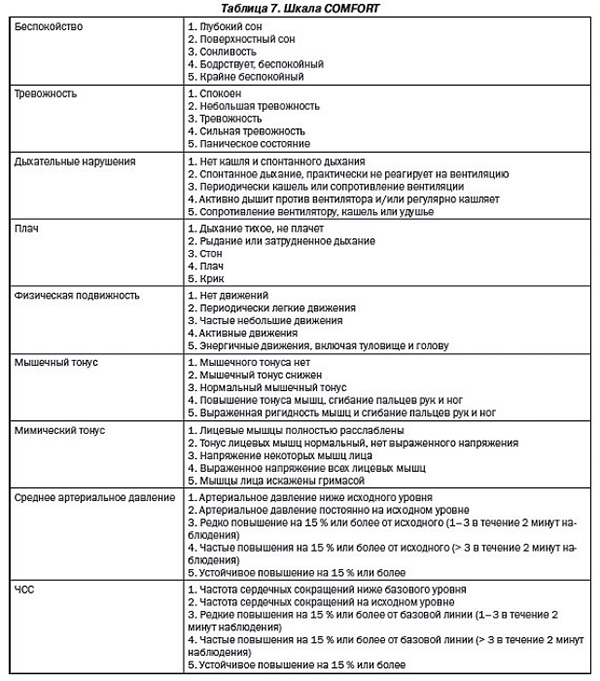
Шкала COMFORT. Детям, находящимся в критическом состоянии, как правило, проводится респираторная поддержка. Для более точной и подробной оценки уровня боли и седации у таких пациентов разработана шкала COMFORT. В исследованиях по валидации и оценке эффективности шкалы COMFORT большинство участников – дети до 4 лет, которым проводилась ИВЛ, однако данная шкала может применяться у детей вплоть до 18 лет. В данной шкале предлагается оценить 9 критериев. Каждый параметр оценивается от 1 до 5 баллов. Диапазон от 17 до 26 баллов свидетельствует об адекватной седации и обезболивании; 9–16 баллов – о передозировке седативных средств; больше 26 баллов – о недостаточной седации и обезболивании.
Практические аспекты применения шкал оценки боли у новорожденных
Инструментальные методы оценки состояния новорожденного ребенка, такие, как электроэнцефалография (ЭЭГ), амплитудно-интегрированная ЭЭГ, электрокардиография и т.д., к сожалению, полностью не заменят экспресс-тесты для измерения боли. В настоящее время только две шкалы имеют модификации с поправками на гестационный возраст пациента: профиль боли у недоношенных детей (PIPP) и шкала боли и седации у новорожденных (N-PASS).
Заключение
Таким образом, современные подходы к оказанию неонатологической медицинской помощи предполагают четкое осознание и понимание того, что новорожденные дети испытывают боль, оценку выраженности которой можно объективизировать при помощи различных методов и инструментов, основанных на внимательном, тщательном и динамическом изучении физиологических и поведенческих реакций ребенка. Перенесенная в раннем неонатальном периоде боль оставляет последствия в виде нарушений неврологического и поведенческого развития. К сожалению, до настоящего времени в неонатальной практике не разработан универсальный подход к оценке боли у новорожденных детей, поэтому необходимы дальнейшие исследования в отношении эффективности тех или иных существующих инструментов клинической оценки боли. Внедрение в клиническую работу отделений реанимации и интенсивной терапии шкал оценки боли у новорожденных в зависимости от гестационного возраста пациентов, хирургического или терапевтического профиля неонатальных отделений позволит объективизировать и минимизировать уровень боли у новорожденных детей, что, несомненно, улучшит результаты лечения и качество жизни таких пациентов.
Андреев А.В., Харламова Н.В., Межинский С.С., Шилова Н.А., Карпова А.Л.,
Мостовой А.В., Песенкина А.А.
Российский вестник перинатологии и педиатрии том 65, № 4 (2020)
Источник
Что мы знаем о боли у новорожденных?
Способы оценки боли. Стратегия профилактики и лечения.
(Клиническая лекция)
И.А. Саввина 1,2 , А.А. Борисова 3 , В.Ю. Новиков 1 , В.И. Гурская 1
1 ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России, Санкт-Петербург, РФ
2 ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава РФ, Санкт-Петербург, РФ
3 Schneider Children’s Medical Centre of Israel, Petah Tikva, Israel
Резюме
Безопасное и эффективное лечение боли у новорожденных требует наличия информативных и достоверных способов её оценки. Оценка болевого синдрома у новорожденного является первым этапом в выборе дальнейшей тактики обезболивания, коррекции проводимого лечения. Приведенные в статье шкалы оценки боли у новорожденных могут быть использованы в ежедневной практике врачей неонатологов, детских анестезиологов-реаниматологов.Стратегия профилактики и лечения болевого синдрома определяется четким представлением о причинах возникновения боли у новорожденного, составлением плана действий с применением нефармакологических и фармакологических методов купирования болевого синдрома.
Ключевые слова: боль, новорожденный, шкалы оценки боли, профилактика и методы лечения боли
Актуальность
Боль остается актуальной проблемой современной хирургии и отделений анестезиологии и реанимации. Безопасное и эффективное лечение боли у новорожденных требует, в первую очередь, наличия информативных и достоверных способов её оценки. Существуют две основные особенности оценки интенсивности боли и эффективности анальгезии в неонатологии:
— невозможность активного сотрудничества пациентов при выполнении исследований;
— отсутствие четкой границы, после которой физиологические и поведенческие реакции однозначно указывают на боль.
В то же время, именно у данной группы пациентов из-за незрелости развивающейся в постнатальном периоде нервной системы некупированная боль приводит к развитию неадекватных стресс-ответов с изменениями белкового метаболизма, ослаблением иммунного ответа и формированием патологических реакций на боль в отдаленном будущем.
Боль — неприятное сенсорно-эмоциональное переживание, связанное с истинным или потенциальным поврежением тканей.
Восходящие пути болевой чувствительности (спиноталамический путь) функционально активны с 20-й недели гестации. Таламические афференты начинают достигать соматосенсорной зоны в возрасте 20 недель и визуализируются с 20-22 недели гестации. Эти афференты являются достаточно зрелыми морфологически и образуют синапсы с подкорковыми нейронами примерно к 21-й неделе гестации. После 23-30-й недели внутриутробного развития начинается миелинизация нервных трактов, вовлеченных в ноцицепцию. Таламокортикальный путь полностью миелинезирован к 37-й неделе гестации, однако остальные пути миелинезируются позже. У новорожденных детей слабо выражена дифференцирующая способность коры головного мозга, что ограничивает возможности психоэмоционального выражения болевых ощущений и делает ответную реакцию на различные болевые воздействия чрезмерной и мало специфичной.
Причин возникновения боли у новорожденных детей может быть множество, и свидетельствовать они могут о различных заболеваниях: родовой травме, гнойно-воспалительных заболеваниях, врожденных пороках развития. Кроме того, появление боли может быть связано с медицинскими манипуляциями и оперативными вмешательствами.
Основные причины неадекватной анальгезии у новорожденных:
- убеждение некоторых врачей, что новорожденные дети не ощущают боль или менее чувствительны к ней;
- безграмотное убеждение некоторых врачей, что «хорошая седация лучше любой анальгезии»;
- отсутствие общепринятых, простых методов выявления и оценки болевого синдрома;
- редкое или в меньших дозах использование наркотических анальгетиков из-за опасения возникновения побочных эффектов, в частности угнетения дыхания;
- неиспользование ненаркотических анальгетиков в качестве доказанного эффективного метода обезболивания;
- невозможность или ограничение современных методов анальгезии из-за технической сложности, отсутствия навыков, опыта использования, в частности, регионарных методов обезболивания;
- отсутствие препаратов, разрешенных для использования в неонатальном периоде.
Физиологический ответ новорожденного на боль представлен в таблице 1.
Оценка болевого синдрома у новорожденного является первым этапом в выборе дальнейшей тактики обезболивания, коррекции проводимого лечения. Для повседневной практики предложено несколько шкал оценки боли:
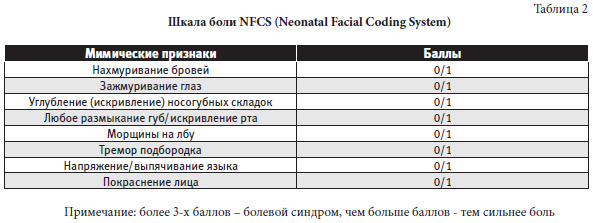
1. Шкала боли NFCS (Neonatal Facial Coding System) представлена в таблице 2.
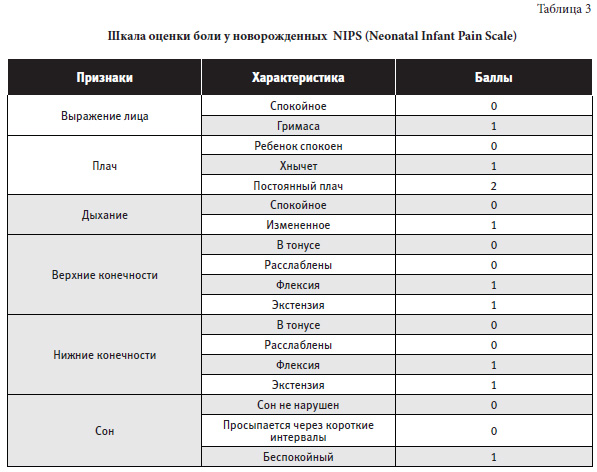
Примечание: более 3-х баллов – болевой синдром, чем больше баллов — тем сильнее боль Шкала оценки боли у новорожденных NIPS (Neonatal Infant Pain Scale) представлена в таблице 3.
Примечание: баллы по 6 показателям суммируются; 0 – нет боли, 3-5 баллов – умеренно выраженная боль; >5 баллов – сильная боль. Низкий балл может наблюдаться у детей в тяжелом состоянии на фоне медикаментозной седации.
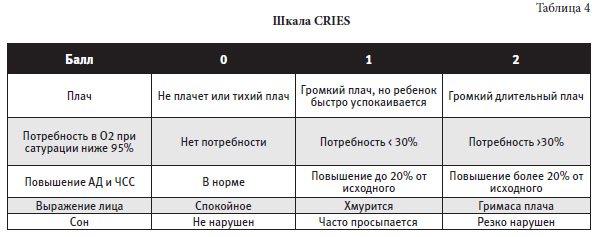
Шкала CRIES (Crying, Requires increased oxygen, Increased vital signs, Expression, Sleeplessness) (Krechel and Bildner, 1995) разработана для использования у новорожденных с 32 недель гестационного возраста до 6 месяцев. Каждый из пяти показателей этой шкалы оценивается от 0 до 2 баллов. Представлена в таблице 4.
Стратегия профилактики боли
- У новорожденного нужно предугадать боль. Это просто — что больно вам, то больно и для новорожденного малыша! Сложнее обезболить малыша при выраженных болевых ощущениях, чем предупредить их развитие.
- Ограничение количества пункций, уколов. За одну пункцию следует стремиться сделать забор большего количества анализов для микроаналитических методик.
- Ограничение использования центральных катетеров (катетер-линия, пупочные, венозный и артериальный катетеры).
- Отказ от инвазивного мониторинга и переход на транскутанный мониторинг, если позволяет состояние новорожденного.
- Необходимо снизить частоту осмотров подвздутого, увеличенного «хирургического» животика малыша. Хотя в ряде случаев это по-медицински может быть и оправдано, но для малыша крайне болезненно.
- Болезненные процедуры должен производить более подготовленный, опытный персонал.
- Бережное проведение перевязок и удаление пластыря.
- Обеспечение адекватной премедикации перед инвазивными процедурами.
- Применение соответственного атравматичного/малотравматичного оборудования и инвентаря (мелкие иглы).
Этапы обеспечения адекватного обезболивания
1. Определение цели применения обезболивающей терапии: выполнение рутинных ежедневных манипуляций, постановка венозных катетеров, проведение анестезиологического пособия, послеоперационное обезболивание.
2. Оценка выраженности болевого синдрома с применением специальных шкал.
3. Построение плана профилактики и лечения болевого синдрома: выбор препарата, выбор дозы, выбор тактики введения (болюсное, методом постоянной инфузии, регионарная, местная).
4. Оценка эффективности обезболивания и коррекция плана лечения боли при недостаточном обезболивании.
Для отделения анестезиологии и реанимации новорожденных (ОАиРН) можно адаптировать трехступенчатую «лестницу» обезболивания ВОЗ:
1-я ступень – слабая боль: нефармакологические методы и/или парацетамол в/в 2-я ступень – умеренно выраженная боль: парацетамол в/в + промедол/кетамин 3-я ступень – сильная боль — боль после «больших» оперативных вмешательств: парацетамол + сильные опиоидные анальгетики — фентанил, морфин болюсно или постоянным введением.
На каждой ступени необходимо рассмотреть возможность адъювантной терапии:
— седативная терапия;
— регионарные методы обезболивания.
Методы лечения болевого синдрома
1. Нефармакологические методы — соответствуют принципам программы NIDCAP (Neonatal Individualized Developmental Care and Assessment Program), разработанной в 1984 году в США доктором психологии Heidelise Als из Бостонской детской клиники и Гарвардской медицинской школы. Целью данной программы является грамотная организация ухода за новорожденными с учетом их анатомо-физиологических особенностей, а также моделирование условий, максимально приближенных к внутриутробным и исключающим стрессовые агрессивные воздействия. Схема включает в себя:
А) Создание комфортной среды:
— микроклимат, правильное положение тела;
— иммобилизация шейного отдела позвоночника при родовых травмах, конечностей при переломах;
— защита целостности кожных покровов;
— щадящая тактильная стимуляция, в том числе и бережное удаление пластыря;
— своевременный туалет и смена мокрых пеленок;
— деятельность медицинского персонала следует ориентировать «с доминантой на ребенка»;
— инвазивные процедуры должны осуществляться атравматичным (малотравматичным) оборудованием только подготовленным персоналом с увеличением периодов отдыха между болезненными манипуляциями — поддерживание у ребенка чувства его «безопасности», «нужности», «сопереживания» со стороны окружающих взрослых, бережное пеленание, нежное поглаживание, соска, ласковая речь, участие родителей в уходе (метод «кенгуру», «skin to skin»);
Б) Применение раствора сахарозы или глюкозы через соску. За 2 мин (интервал 2 мин от начала использования раствора per os до возникновения обезболивания совпадает со временем, необходимым для освобождения эндогенных опиоидов) перед болезненной процедурой детям назначают сахарозу (глюкозу) с концентрацией более 20% (оптимальная — 24%) в дозе 0,1–0,5 мл/кг, используя шприц, или обмакивая в раствор соску-пустышку;
2. Фармакологические методы коррекции болевого синдрома:
А) Местная анестезия — ЭМЛА-крем — его эффективность показана во время люмбальной пункции, пункции вен и артерий, обрезании крайней плоти и внутримышечных инъекций. При уколе пальца или пятки для забора крови аналгезия не подтверждена. Крем рекомендуется для применения у детей старше 34 недель гестации, однократно в течение суток. При превышении дозы или экспозиции возможно образование метгемоглобина, особенно у недоношенных детей до 26 недель гестации. Длительность аппликации должна быть 30 мин;
Б) Регионарные методы анальгезии – лекарственные средства селективного действия, целенаправленно обеспечивающие обратимое прерывание в первую очередь болевых импульсов в проводниках периферической нервной системы. В последнее время для купирования процедурной и послеоперационной боли у новорожденных возросло применение местных анестетиков по таким направлениям, как локальная инфильтрация, блокады нервных периферических стволов, спинальное введение. Регионарные методы следует рассматривать не как альтернативу общей анальгезии, а как ее возможный дополнительный компонент. Самым изученным и используемым методом у новорожденных является каудальная эпидуральная анальгезия. Эпидуральное пространство новорожденных заполнено рыхлой жировой тканью с низким содержанием фиброзных волокон, что позволяет проводить эпидуральный катетер на любой уровень вдоль позвоночного столба. В тоже время вены эпидурального пространства не имеют клапанной системы. Т.о., случайная инъекция анестетика, введение воздуха и т.д., приводит к развитию системной токсической реакции. Техника выполнения:
Выполнение катетеризации должно выполняться в условиях общей анестезии, чаще всего р-р кетамина 1-2 мг/кг. Крестцово – копчиковая мембрана пунктируется по средней линии максимально высоко на уровне рожек крестцовой кости. Известны 2 способа:
1. Кожу пунктируют под углом 90 градусов, с дальнейшим поворотом иглы на 30-40 градусов в краниальном направлении при прохождении hiatus sacralis при достижении эпидурального каудального пространства;
2. «Техника без поворота иглы» — пункция крестцово-копчиковой связки под углом 60 градусов;
Расчет дозы анестетика по схемам Armitadge – 0,5—1—1,25 мл/кг в зависимости от необходимого уровня блока. Для продленной инфузии используется раствор бипивакаина 0,0625% в дозе 0,1-0,2 мл/кг/ час. Добавление наркотического анальгетика — промедол 0,1 мг/кг, морфин 0,03 мг/кг обеспечивают анальгезию до 14 часов.
В) Ненаркотические анальгетики – самым изученным и безопасным у новорожденных является парацетамол 1% — анальгетик 1-й ступени ВОЗ. Является обезболивающим и жаропонижающим средством.
Блокирует синтез простагландинов ( ПГ) в ЦНС. Нарушает проведение болевых импульсов в афферентных путях, уменьшает пирогенное действие ПГ на центр терморегуляции в гипоталамусе, усиливает теплоотдачу. Доза: 10-15 мг/кг в/в каждые 6-8 часов.
Г) Опиоидные анальгетики – являются препаратами первой линии для лечения острой и сильной боли. Ключевым принципом для их безопасного и эффективного использования является титрование дозы.
Морфин гидрохлорид 1% — однократная доза: — 0.05-0.2 мг/кг в/в в течение 5 мин. Повторять дозу можно каждые 4-6 часов. Продленная инфузия: доза насыщения — 100-150 мкг/кг в течение первого часа.
Поддерживающая доза — 10-20 мкг/кг в течение часа. Относится к списку off-label препаратов, при назначении необходим протокол.
Фентанил 0,005% — однократная доза 1-4 мкг/кг медленно в/в. Повторять можно каждые 2-4 часа.
Продленная инфузия: доза 1-5 мкг/кг. Постоянная концентрация достигается очень быстро. При проведении анестезиологического пособия доза препарата 5-50 мкг/кг, каждые 15-25 минут.
Тримеперидин гидрохлорид 2% (Промедол) – однократная доза 0,05 – 0,3 мг/кг, для обезболивания повторное введение промедола рекомендуется использовать через 4-6 часов. В качестве компонента общей анестезии вводят внутривенно 0,5-2,0 мг/кг/час. Суммарная доза во время операции не должна превышать 2 мг/кг/час. Для постоянной внутривенной инфузии промедол вводят 10-50 мкг/кг/час (0,01-0,05 мг/кг/час).
Д) Антагонист NMDA – рецепторов — кетамин 5% — препарат выбора для проведения малых оперативных вмешательств, не требующих выключение самостоятельного дыхания; для проведения манипуляций в ОАиРН (постановки центральных венозных катетеров, люмбальная пункция, обеспечение общей анестезии при постановке эпидуральных катетеров и т.п.). NMDA рецепторная активация – важный компонент центральной сенсибилизации, в отличие от взрослого населения, у новорожденных эти рецепторы присутствуют во всем сером веществе дорсального рога спинного мозга в более высокой концентрации и с генерализованным распространением реакции. Дозировка: однократная доза 1-2 мг/кг в/в; в/м 3-5 мг/ кг. Продленная инфузия – 0,5 – 1,8 мг/кг/час (8-30 мкг/кг/мин).
Адьювантная терапия:
1. Бензодиазепины – диазепам 0,3-0,5 мг каждые 8 часов (относится к списку off-label препаратов, при назначении необходим протокол). Мидазолам – 0,05-0,15 мг/кг каждые 2-4 часа, продленная инфузия – 10-60 мкг/кг/час;
2. Барбитураты – тиопентал натрия 2-6 мг, продленная инфузия 1-4 мг/кг/час;
3. Пропофол – 2,5-3,0 мг/кг, продленная инфузия – 9-14 мг/кг/час;
4. Натрия оксибутират – 100 – 150 мг болюсное введение, продленная инфузия 25 – 50 мг/час;
5. Миорелаксанты: панкуроний 0,04 -0,15 мг/кг; пипекуроний бромид (ардуан) – 0,05-0,1 мг/кг.
Шкала оценки боли у недоношенных новорожденных (Premature infant pain profile), предложенная в 1996 г. авторами Stevens B., Johnston C., Petryshen P.,Taddio A., отображена в таблице 5.
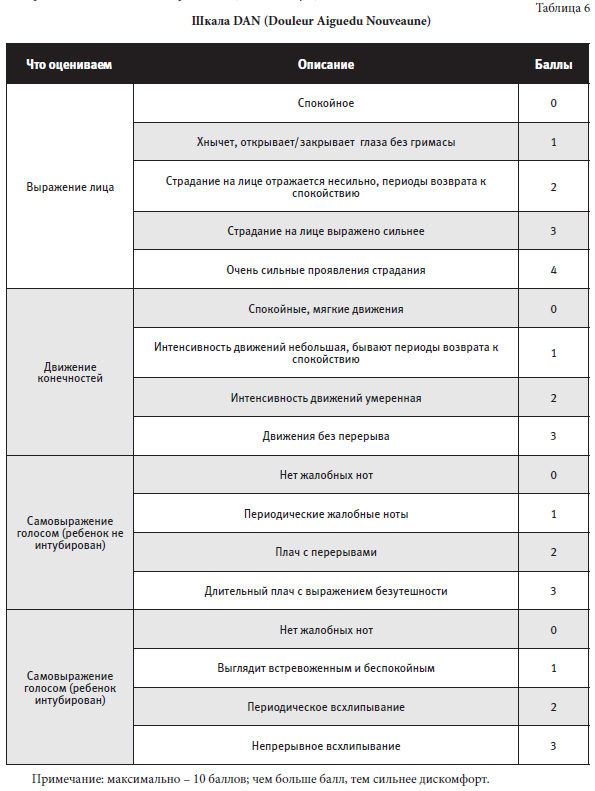
Шкала DAN (Douleur Aiguedu Nouveaune) используется для оценки острой и хронической боли у новорожденных по внешним признакам ( см. таблицу 6).
Для оценки боли у новорожденных, которые находятся на искусственной вентиляции легких (ИВЛ), используют шкалу COMFORT ( таблица 7).
Примечание: каждый показатель оценивается по шкале от 1 до 5. Значения от 17 до 26 свидетельствуют об адекватной седации и обезболивании.
Ниже перечислены болезненные диагностические манипуляции и лечебные процедуры, проводимые у новорожденных в ОаиРН.
Диагностические манипуляции :
— пункция артерии;
— бронхоскопия;
— эндоскопия;
— пункция пятки;
— люмбальная пункция;
— осмотр глаз (ретинопатия и др.) ;
— пункция мочевого пузыря;
— пункция вены.
Tерапевтические процедуры:
— катетеризация мочевого пузыря;
— введение и удаление центральных катетеров;
— введение и удаление дренажа в полость плевры;
— физиотерапия грудной клетки;
— перевязка;
— введение желудочного зонда;
— внутримышечные инъекции;
— лазерная терапия для лечения ретинопатии;
— катетеризация периферических вен;
— мeханическая вентиляция;
— дренажные положения;
— удаление лейкопластыря;
— удаление швов;
— интубация/экстубация трахеи;
— пункция желудочков мозга.
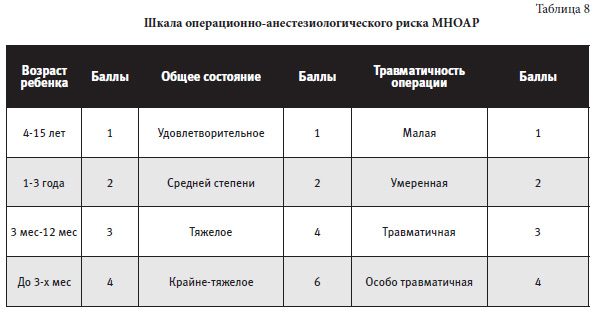
Оценка риска:
I ст (незначительная) — 3 балла II ст (умеренная) — 4-5 баллов III ст (средняя) — 6-7 баллов IV ст (значительная) — 8-10 баллов V ст (чрезвычайная) — <10 баллов
Литература
- Современные возможности лечения острой послеоперационной боли у пациентов детского возраста / Кондратьев А.Н., Саввина И.А., Хачатрян В.А., Лебедева А.О. // Нейрохирургия и неврология детского возраста. — 2007. — № 3. — С. 30-36.
- Лебедева А.О. Упреждающая антиноцицептивная терапия в детской анестезиологии // Актуальные вопросы клинической и экспериментальной медицины. Сборник тезисов к научно-практической конференции молодых ученых. — Спб., 2009. — С. 212-214.
- Pain in neonates and infants / Edited by K.J.S. Anand, B.J. Stevens, P.J. McGrath // Third edition, Elsevier, 2007. — 329 P.
- Julia Harris, Anne-Sylvie Ramelet, Monique van Dijk, et al. Clinical recommendations for pain, sedation, withdrawal and delirium assessment in critically ill infants and children: an ESPNIC position statement for healthcare professionals. Guidelines.// Intensive Care Med. — 2016. — №42. — P. 972-986.
Тольяттинский медицинский консилиум. №3-4 2017
Источник