- 5 нейромедиаторов: от серотонина до глутаминовой кислоты
- Глутаминовая кислота
- Дофамин
- Норадренан
- Ацетилхолин
- Серотонин
- Химические модуляторы памяти
- Конкурс «био/мол/текст»-2014
- Зачем нужно изменять память?
- Как работает долговременная потенциация
- Много не значит хорошо
- Модуляторы памяти, действующие на рецепторы гамма-аминомасляной кислоты и глутамата
- Модуляторы памяти, действующие косвенным способом
- Заключение
- Нерешённые проблемы
5 нейромедиаторов: от серотонина до глутаминовой кислоты
Основной структурной и функциональной единицей мозга являются синапсы — контакты между нервными клетками, через которые передается сигнал. Главную роль в этом процессе играют нейромедиаторы — биологически активные вещества, которые выделяются из аксонов, отростков нервных клеток, и воздействуют на следующую клетку. Мы собрали несколько основных медиаторов, которые регулируют работу нашего организма — от движений пальцев до чувства боли.
Глутаминовая кислота
Это один из важнейших медиаторов в мозге: глутаминовую кислоту, или глутамат, выделяют около 40% нейронов. Связывание глутаминовой кислоты с рецепторами нейронов приводит к их возбуждению. С ее помощью передается информация, связанная с сенсорикой, движением и памятью. Сходные аминокислоты мы получаем из пищи: глутамат входит в состав многих белков. Таким образом, за день мы съедаем от 5 до 10 граммов глутамата и глутамина. Тем не менее пищевой глутамат в мозг практически не попадает: гематоэнцефалический барьер, который окружает сосуды, пронизывающие мозг, строго контролирует движение химических веществ из крови в нервную систему. Если все же это случается, например когда человек съедает большое количество глутамата, чувствуется лишь небольшое возбуждение. Но специально подпитывать мозг не нужно: нейроны самостоятельно синтезируют это вещество прямо в окончаниях аксонов и выделяют его для передачи информации.
Существует около десяти типов глутаматных рецепторов, которые с разной скоростью проводят сигналы. Чаще всего они изучаются с точки зрения анализа механизмов памяти. А фармакологи используют их для торможения нервной системы: при наркозе используется кетамин, для лечения нейродегенеравтивных заболеваний и уменьшения вероятности эпилептических припадков — мемантин, который блокирует эти рецепторы.
Дофамин
Этот нейромедиатор является одним из химических факторов внутреннего подкрепления. Он вызывает чувство удовлетворения, чем влияет на процессы мотивации и обучения. Дофамин вырабатывается при получении позитивного опыта: секса, вкусной пищи, приятных ощущений. Дофаминовые нейроны располагаются в трех зонах мозга: гипоталамусе, черной субстанции и вентральной покрышке. В зависимости от расположения различаются их функции. Нейроны в гипоталамусе регулируют либидо, агрессивность и пищевую мотивацию. От количества дофамина в черной субстанции зависит подвижность человека: насколько охотно он занимается спортом, гуляет и танцует. Также этот нейромедиатор чрезвычайно важен для когнитивной деятельности: дофамин, который вырабатывается в вентральной покрышке, отвечает за скорость обработки информации. Эта зона мозга также дает человеку положительные эмоции, связанные с новизной, творчеством и юмором.
Норадренан
Норадреналин часто путают с адреналином, но между ними есть большая разница: адреналин — это гормон, а норадреналин — нейромедиатор. Оба вещества образуются из тирозина — одной из 20 аминокислот, входящих в состав белков пищи. Когда мы принимаем пищу, богатую тирозином, мы получаем несколько граммов норадреналина или адреналина, которые активируют нервную систему и многие органы.
Норадреналин является главным медиатором симпатической нервной системы. Эта часть мозга и нервные волокна управляют
внутренними органами во время стресса, физической и эмоциональной нагрузки, больших энергозатрат. Он способен как разогнать, так и затормозить процессы, происходящие в теле: активировать работу сердечной мышцы, сузить сосуды или, наоборот, расслабить стенки бронхов и кишечника. Эти разнонаправленные изменения зависят от типа рецепторов, откликающихся на появление норадреналина. От него зависят и когнитивные функции: нейромедиатор участвует в процессах обучения и запоминания информации.
Ацетилхолин
Этот медиатор вырабатывается в нейромышечных синапсах и отвечает за движения. Если вы захотите пошевелить пальцем, мозг отправит электрический сигнал в мышечные нервы, где выделяется ацетилхолин, который и вызывает сокращение мышцы. Те же рецепторы, на которые воздействует ацетилхолин, воспринимают и никотин. Этот токсин, содержащийся в листьях табака, вызывает у насекомых судороги, тем самым защищая растение. Ацетилхолин также отвечает за работу вегетативной нервной системы, которая управляет внутренними органами. Помимо периферических функций, ацетилхолин ответственен за работу головного мозга: он способен как понижать уровень возбуждения, так и, наоборот, активировать мозг.
Серотонин
Серотонин одновременно является медиатором центральной нервной системы и тканевым гормоном: мы можем обнаружить его в самых разных органах и тканях. В головном мозге серотонин выполняет тормозящую функцию и является важным компонентом центров сна. Также он способен контролировать общий уровень болевой чувствительности: у людей, которые легко переносят боль, вырабатывается много этого вещества. Но самая известная функция серотонина — контроль отрицательных эмоций. Нейромедиатор подавляет центры мозга, связанные с обидой, печалью, разочарованием. Проблемы в работе серотониновой системы влечет за собой депрессию, которая лечится с применением определенных препаратов — они блокируют механизм инактивации этого нейромедиатора, который в нормальных условиях нужен для того, чтобы прекратить передачу сигнала.
Источник
Химические модуляторы памяти
Гиппокамп — одна из ключевых структур мозга, отвечающих за работу памяти. На рисунке — срез гиппокампа кролика (вид под микроскопом): показаны пирамидные клетки. Автор рисунка — нобелевский лауреат 1906 года Камилло Гольджи.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Нейробиологи и фармакологи давно работают над созданием веществ, способных оказывать влияние на память. В статье рассмотрены представители некоторых известных на сегодня классов позитивных и негативных химических модуляторов памяти, изменяющих долговременную потенциацию пирамидных клеток гиппокампа. Приводится механизм их действия, область применения и классификация.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Зачем нужно изменять память?
Вся человеческая деятельность основана на способности мозга хранить однажды полученную информацию, т.е. на памяти. Интересно поразмышлять, насколько далеко шагнул бы прогресс, если бы после сна все наши воспоминания стирались. К счастью, этого не происходит, так как мозг умеет успешно переводить информацию из кратковременной памяти в долговременную. Полагают, что эту функцию осуществляет гиппокамп — небольшое, но очень древнее в эволюционном плане образование, которое имеется в каждом из двух полушарий. В ответ на информационный стимул происходит возбуждение некоторого числа пирамидных клеток гиппокампа, которое далее передаётся в кору, где и хранится, ожидая своего часа [1].
Но раз память — одно из важнейших свойств нашего мозга, необходимое для нормального функционирования, значит, любое влияние, которое она будет испытывать, должно самым существенным образом сказываться на нашей обыденной жизни. Увы, избежать многих негативных влияний невозможно: травмы, болезни (например, болезнь Альцгеймера), не всегда здоровый образ жизни, старость — всё это медленно, но верно ослабляет память и ухудшает нашу адаптацию к существующим условиям, поэтому вполне закономерной является задача противостоять этим влияниям и не давать памяти ослабнуть. Правда, некоторые воспоминания, связанные с неприятными, порой угрожающими жизни событиями, являются для психики травмирующими, и их хочется поскорее забыть.
Позитивная и негативная модуляция памяти объективно необходимы для продолжения нормальной жизнедеятельности, в том числе при многих заболеваниях. Рассмотрим, какими химическими средствами можно модифицировать память и каким образом эти средства действуют.
Как работает долговременная потенциация
В основе памяти лежит физиологическое явление, которое носит название долговременной потенциации (ДП). ДП — это явление, при котором проведение нервного импульса между нейронами приводит к резкому усилению проведения последующих импульсов в образованном ими синапсе [2]. Основным игроком этого процесса, протекающего в гиппокампе (а также в других частях мозга), является пирамидная клетка, на мембране которой находится две разновидности глутаматных рецепторов: AMPA- и NMDA-рецепторы.
При развитии ДП происходят следующие события (рис. 1):
- пресинаптический нейрон, контактирующий с пирамидной клеткой, выделяет глутамат — возбуждающий нейромедиатор;
- глутамат, связываясь с AMPA-рецепторами, изменяет их конформацию таким образом, что ионный канал, расположенный внутри рецептора, начинает пропускать внутрь пирамидной клетки ионы натрия;
- поступление ионов натрия вызывает изменение распределения зарядов (локальную деполяризацию), затрагивающее и находящиеся рядом NMDA-рецепторы;
- локальная деполяризация приводит к тому, что ион магния, закрывающий ионный канал NMDA-рецепторов, покидает своё место;
- глутамат связывается с NMDA-рецепторами, в результате чего их свободные от ионов магния каналы начинают пропускать внутрь пирамидной клетки ионы натрия и кальция.
Поступающие внутрь пирамидной клетки ионы кальция вызывают в ней изменения, которые приводят к ещё большему увеличению проводимости синапса за счёт усиления активности существующих рецепторов, увеличения количества AMPA-рецепторов и увеличения площади самого синапса.
Рисунок 1. Механизм развития долговременной потенциации (high frequency stimulation producing LTP)
Каким же образом ДП обеспечивает запоминание? ДП упрочняет связи между нейронами и ускоряет проведение нервного импульса по цепочкам нейронов, принявших совместное участие в передаче информации. В дальнейшем проведение нервного импульса по этим цепочкам будет происходить с меньшим количеством задержек и ошибок, т.е., к примеру, однажды воспроизведённая информация может быть повторена c большей лёгкостью.
Много не значит хорошо
Казалось бы, нет ничего проще, чем усилить ДП, а значит и память, путём непосредственной стимуляции AMPA- и NMDA-рецепторов. Однако по двум причинам такой подход используется ограниченно.
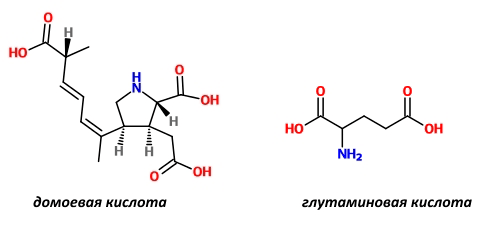
Во-первых, чрезмерная стимуляция AMPA- и NMDA-рецепторов может привести к неконтролируемому всплеску активности нейронов, а это чревато развитием судорог. Таким влиянием обладают некоторые токсины водорослей, например, домоевая кислота, имеющая высокое сродство к AMPA-рецепторам [3] (рис.2).
Рисунок 2. Домоевая и глутаминовая кислоты
Во-вторых, избыточная активация NMDA-рецепторов вызывает поступление в пирамидные клетки слишком большого количества ионов кальция, что для них весьма губительно. Явление гибели нейронов под действием избытка ионов кальция получило название «эксайтотоксичность» (от англ. to excite — возбуждать).
Тем не менее, вещества, так или иначе способствующие деполяризации пирамидных клеток, будут усиливать ДП, а соединения, приводящие к их гиперполяризации — наоборот, будут её ослаблять.
Модуляторы памяти, действующие на рецепторы гамма-аминомасляной кислоты и глутамата
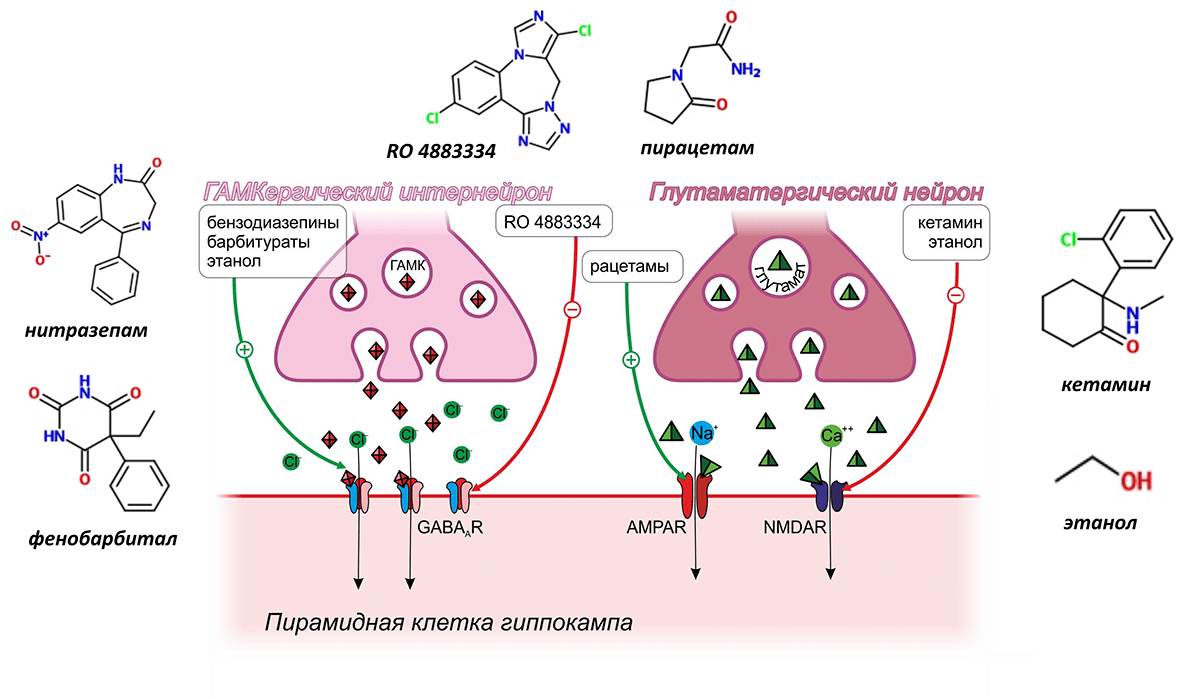
Действие всех модуляторов памяти так или иначе затрагивает проведение импульса пирамидной клеткой. Подробнее рассмотрим ту группу веществ, которые оказывают непосредственное влияние на рецепторы глутамата и γ-аминомасляной кислоты (ГАМК) (рис. 3).
Рисунок 3. Модуляторы памяти, действующие на рецепторы ГАМК и глутамата
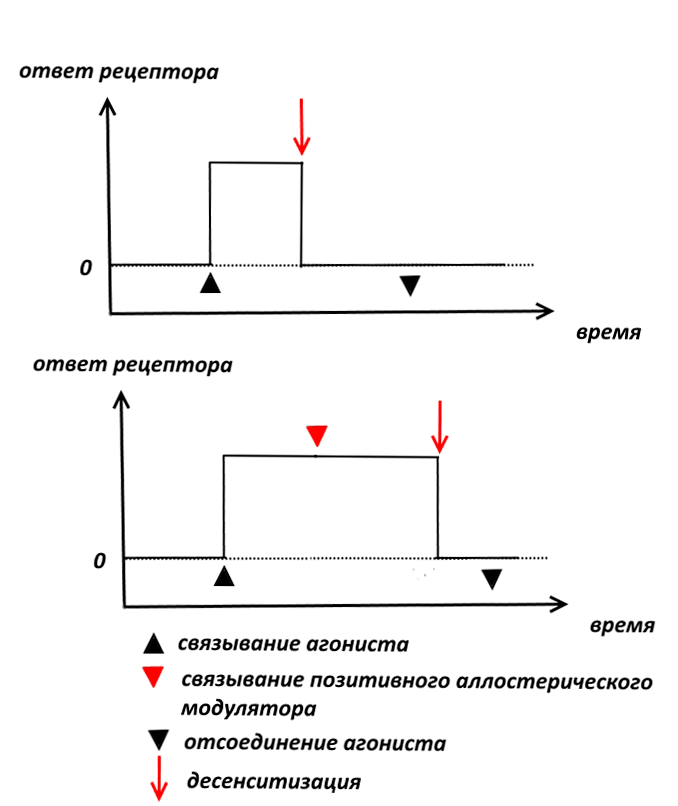
Наиболее известными специфическими позитивными модуляторами памяти являются рацетамы, родоначальник которых, пирацетам, разработан бельгийской компанией UCB в конце 60-х годов прошлого века [4]. Механизм действия рацетамов связан с аллостерической модуляцией AMPA-рецепторов, в результате которой уменьшается время, в течение которого рецептор находится в десенситизированном (от лат. sensus — чувство, ощущение) состоянии (рис. 4).
Рисунок 4. Позитивные аллостерические модуляторы рецепторов могут замедлять наступление десенситизации и отсоединение агониста
Если связь рецептора с агонистом, т.е. веществом, которое приводит его в активное состояние, длится достаточно долго, то рецептор переходит в неактивное, так называемое десенситизированное состояние. Десенситизация рецепторов призвана защитить нервную систему от перевозбуждения.
Физиологически активному веществу не обязательно присоединяться к рецептору в том же самом месте, в котором действует агонист. В данном случае присоединение пирацетама и родственных соединений к AMPA-рецепторам происходит в аллостерическом центре (от греч. allos — другой), что затрудняет десенситизацию, в результате чего рецептор дольше находится в активном состоянии [5].
Рацетамы применяются главным образом в Европе и в бывших странах СССР для лечения различных форм деменций, в том числе начальных стадий болезни Альцгеймера, однако существенного замедления развития болезни они не вызывают и используются в основном как вспомогательные препараты [4].
Широкое применение, но уже в качестве негативного модулятора памяти, вызывающего амнезию, нашёл антагонист NMDA-рецепторов кетамин, используемый в качестве средства для наркоза при хирургических вмешательствах [6]. Кетамин встраивается в ионный канал NMDA-рецептора, не давая ионам кальция пройти внутрь пирамидной клетки, делая ДП невозможной.
Алкоголь, точнее содержащийся в нём этиловый спирт , — ещё одна широко известная своей способностью вызывать провалы в памяти субстанция — также является антагонистом NMDA-рецепторов [7].
у этанола есть и другие пути воздействия на нервную систему, например, через связь с G-белок—зависимыми K + -каналами входящего выпрямления (GIRK). Об этом «биомолекула» писала в статье «Действие алкоголя на мозг: найден сайт связывания молекул спиртов» [23]. — Ред.
Пирамидные нейроны гиппокампа интегрируют сигналы, которые являются не только возбуждающими, но и тормозящими. Тормозящие сигналы исходят от вставочных нейронов, выделяющих в синаптическую щель ингибиторный нейромедиатор — ГАМК. И если возбуждающий нейромедиатор вызывает приток в нервную клетку положительно заряженных ионов, то ГАМК через соответствующие ГАМКергические рецепторы открывает путь отрицательно заряженным хлорид-ионам. Их поступление затрудняет последующее возбуждение нейрона и проведение нервного импульса.
К группе негативных модуляторов памяти, которые влияют на рецепторы ГАМК, относятся бензодиазепины (например, нитразепам) и барбитураты (например, фенобарбитал). Как первые, так и вторые являются позитивными аллостерическими модуляторами рецепторов ГАМК, усиливающими за счёт поступления хлорид-ионов гиперполяризацию пирамидных клеток гиппокампа. Производимый этим веществами эффект настолько силён, что они могут вызывать не просто нарушения памяти, а потерю сознания и сон, и поэтому находят широкое применение в медицине в качестве анестезиологического пособия и снотворных препаратов [6]. Позитивным аллостерическим модулятором рецепторов ГАМК является и уже упомянутый этанол, входящий в состав алкогольных напитков [8].
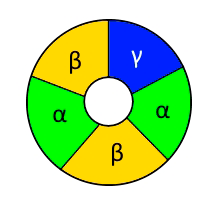
Рисунок 5. Схематическое изображение рецептора ГАМК, состоящего из двух α-, двух β- и одной γ-субъединицы. В центре — канал для хлорид-ионов.
Попытки усилить ДП, а значит, и память путём подавления ГАМКергической передачи начали предприниматься относительно недавно. Причина этого связана с тем, что ингибирование рецепторов ГАМК может запросто привести к таким опасным побочным эффектам как судороги из-за нарушения процессов торможения.
Рецепторы ГАМК, как и рецепторы многих других нейромедиаторов, являются белками с четвертичной структурой и состоят из нескольких различных субъединиц, которые могут варьировать от рецептора к рецептору (рис. 5) [9]. Оказалось, что память и другие когнитивные процессы контролируются преимущественно теми рецепторами ГАМК, которые состоят из α5, β и γ2 субъединиц. Опыты на животных показали, что если избирательно заблокировать их, то судороги развиваться не будут, а память улучшится. Однако такие селективные блокаторы (например, вещество RO 4882224 [10]) пока не вышли за пределы исследовательских лабораторий.
Модуляторы памяти, действующие косвенным способом
По причинам, изложенным выше, активно продолжают разрабатываться те модуляторы памяти, которые непосредственно не связываются с глутаматными рецепторами или рецепторами ГАМК. Такие модуляторы памяти можно классифицировать в зависимости от того, на какие другие рецепторы центральной нервной системы или ионные каналы они действуют.
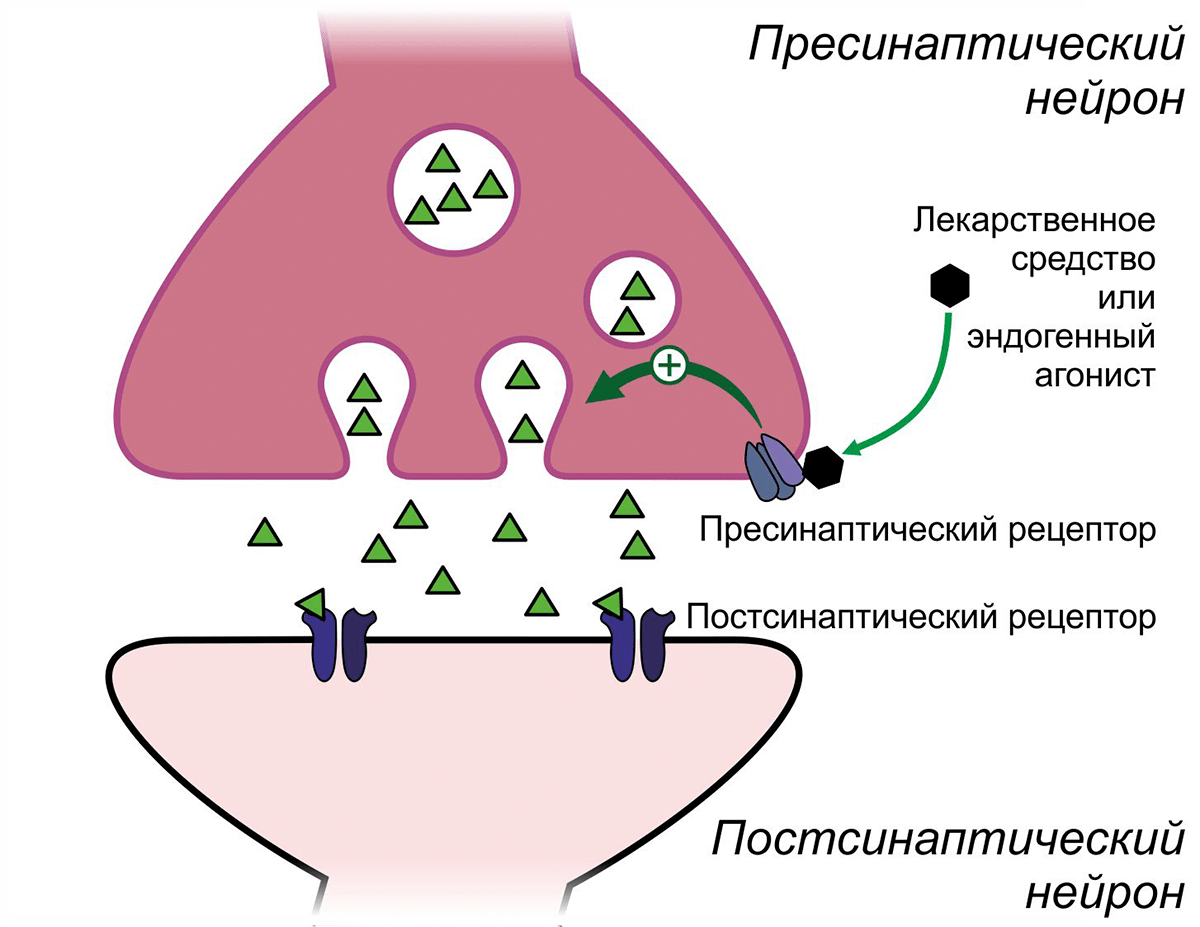
На мембране многих пресинаптических нейронов, передающих нервный импульс другим нейронам, расположены рецепторы, которые регулируют высвобождение нейромедиатора. Путём воздействия на эти пресинаптические рецепторы можно добиться как усиления, так и ослабления этого процесса (рис. 6).
Рисунок 6. Регуляция высвобождения нейромедиатора пресинаптическими рецепторами
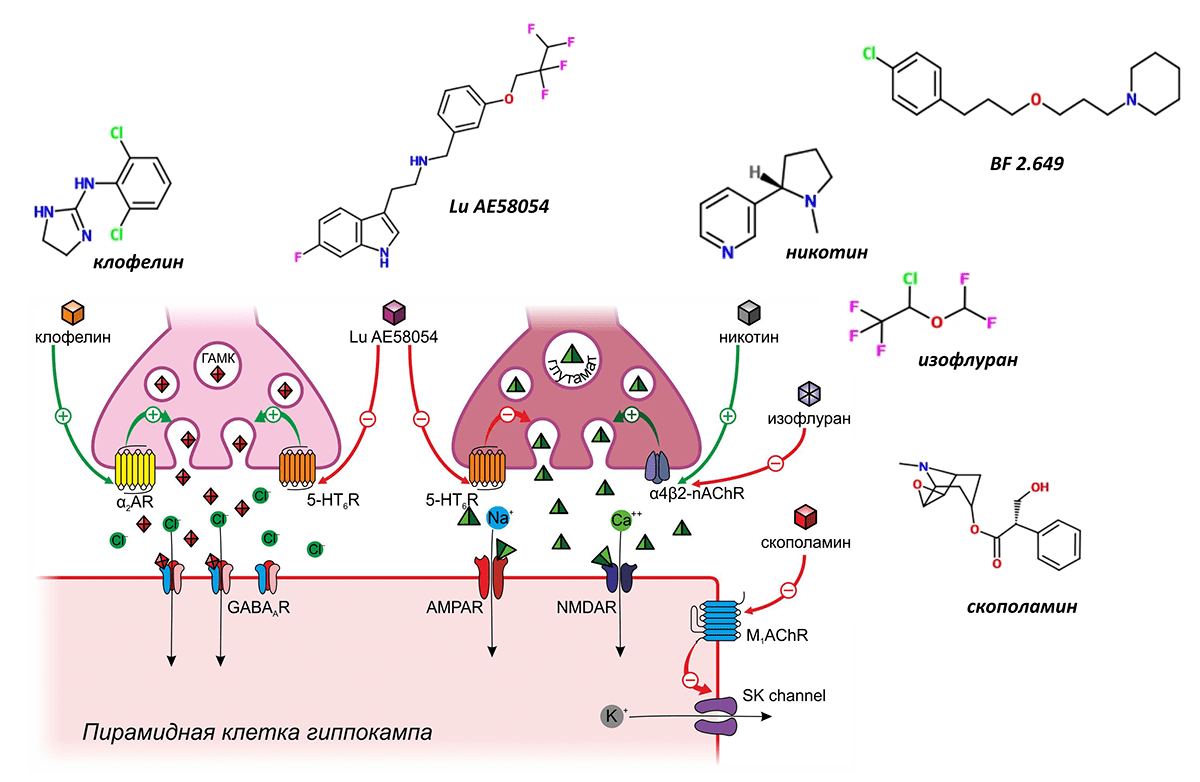
Широко известным негативным модулятором памяти, опосредующим свои эффекты через α2-адренергические рецепторы, является клофелин — герой многочисленных криминальных эпизодов. Этот препарат, созданный для снижения артериального давления, активируя пресинаптические α2-адренергичекие рецепторы ГАМКергических вставочных нейронов, способствует выделению ГАМК, что подавляет активность пирамидных нейронов, вызывая тем самым амнезию (рис. 7) [11]. В настоящее время рассматривается возможность применения клофелина для подавления негативных воспоминаний при посттравматических расстройствах [12].
Рисунок 7. Модуляторы памяти, действующие косвенным способом
Второй мишенью, регулирующей, как полагают, одновременно выделение тормозных и возбуждающих нейромедиаторов, являются серотониновые 5-HT6-рецепторы. Считается, что стимуляция этих пресинаптических рецепторов стимулирует выброс ГАМК и одновременно предотвращает выброс глутамата в синаптическую щель, что в конечном итоге приводит к торможению ДП. В настоящее время проводятся многочисленные клинические испытания блокаторов серотониновых 5-HT6-рецепторов для лечения когнитивного дефицита при болезни Альцгеймера и шизофрении. В наиболее продвинутой III фазе таких испытаний находится вещество Lu AE58054 (рис. 7) [13], [14].
Тем не менее известный противоаллергический препарат димебон, также обладающий способностью блокировать серотониновые 5-HT6-рецепторы (а также α-адренорецепторы, H1-гистаминвые рецепторы и некоторые другие), в подобных клинических исследованиях потерпел фиаско [15].
Примером ещё одного позитивного модулятора памяти, действующего по сходному механизму, является никотин, чьё влияние на память было подтверждено в многочисленных клинических испытаниях , [16], [17]. Полагают, что никотин стимулирует пресинаптические никотиновые ацетилхолиновые рецепторы α4β2-подтипа, вызывая тем самым выброс глутамата, возбуждающего пирамидные клетки и инициирующего ДП (рис. 7) [18]. Не так давно было подтверждено предположение о том, что используемый для ингаляционного наркоза препарат изофлуран подавляет ДП путём ингибирования именно никотиновых ацетилхолиновых рецепторов α4β2-подтипа (рис. 7) [19].
Как-то мы писали об исследовании, в котором продемонстрирована когнитивная роль никотина, позволяющая людям лучше сконцентрироваться на решении различных задач: «Спасибо, дорогой Минздрав, что предупредил!» [24]. — Ред.
Многогранно влияние на ДП и, следовательно, память, веществ, вмешивающихся в работу гистаминовых рецепторов [20]. Наибольшее внимание в качестве модуляторов памяти привлекают антагонисты H3-гистаминовых рецепторов. H3-гистаминовые рецепторы расположены пресинаптически и регулируют высвобождение многих других нейромедиаторов, оказывающих влияние на долговременную потенциацию, в том числе глутамата, ГАМК и ацетилхолина. И хотя точный механизм позитивного влияния антагонистов H3-гистаминовых рецепторов на память остаётся неизвестным, это не мешает им успешно продвигаться в клинических испытаниях. Так, например, препарат BF 2.649 в настоящее время находится в III фазе испытаний в качестве лекарственного средства при шизофрении и болезни Паркинсона [21] (рис. 7).
Мембрана нервных клеток содержит большое количество ионных каналов, не являющихся частью рецепторов. Регулируя их работу, можно также управлять памятью. В качестве примера такого регулятора можно привести скополамин — алкалоид, встречающийся в растениях семейства паслёновых и хорошо знакомый исследователям, изучающим память. Скополамин часто используют для моделирования нарушений памяти у лабораторных животных, однако механизм его действия был раскрыт не так давно (рис. 7). Мембрана пирамидных клеток содержит кальций-зависимые калиевые каналы малой проводимости (КЗКМП), которые активируются ионами кальция при связывании их с внутриклеточными доменами каналов. Активация КЗКМП вызывает утечку ионов калия, создающих необходимый для поддержания ДП трансмембранный потенциал, и поэтому ослабляет память. КЗКМП находятся под контролем мускариновых ацетилхолиновых рецепторов. Посредством G-белков мускариновые рецепторы активируют протеинкиназу, фосфорилирующую внутриклеточный домен каналов, что блокирует связывание кальция и мешает пропускать ионы калия. Скополамин ингибирует мускариновые рецепторы, фосфорилирование внутриклеточного домена прекращается, КЗКМП начинают интенсивно работать, выкачивают из клетки калий, чем затрудняют ДП и вызывают нарушение памяти [22].
Заключение
Таким образом, в зависимости от того, какой эффект (усиление или ослабление) оказывает то или иное соединение на память, все химические модификаторы могут быть разделены на позитивные и негативные. Изменение ГАМКергической и глутаматергической передач, регулирующих ДП, под действием модуляторов памяти может осуществляться как непосредственным связыванием с соответствующими рецепторами, так и косвенным способом. В последнем случае модуляция может осуществляться двумя путями:
- действием на пресинаптические рецепторы, регулирующие выделение возбуждающих и ингибирующих нейромедиаторов;
- изменением активности ионных каналов, влияющих на порог деполяризации пирамидных клеток и ГАМКергических интернейронов.
Нерешённые проблемы
Как следует из обзора, в настоящее время известно большое количество модуляторов памяти, которые могут единообразно воздействовать на многие биологические мишени. Но можно ли считать достигнутый на сегодня результат удовлетворительным? Едва ли. Перечислю круг тех проблем, которые ещё предстоит решить тем, кто разрабатывает модуляторы памяти.
Во-первых, вещества, усиливающие память и применяемые при нейродегенеративных заболеваниях, в подавляющем большинстве не устраняют главную их причину — гибель нервных клеток. Эффективность таких препаратов не может быть высокой, так как при уменьшении числа нейронов ниже критического уровня исчезают и мишени этих лекарственных средств.
Во-вторых, очень актуальна проблема позитивной модуляции памяти здоровых лиц, которые хотят расширить свои возможности при решении профессиональных задач. Большинство улучшающих память препаратов изучается на животных, у которых смоделирована та или иная болезнь, а также на пациентах в ходе клинических испытаний. Но до сих пор отсутствуют подходы к созданию веществ, которые могут повышать «базовый» уровень памяти у людей, не отягощённых заболеваниями.
В-третьих, пока не разработан способ избирательного стирания конкретных воспоминаний.
Надеюсь, что мой обзор подвигнет молодых читателей на решение связанных с модуляцией памяти вопросов и, быть может, станет отправной точкой для их будущих исследований.
Источник