- Архитектура скелетных мышц
- Лекция 1
- Архитектура скелетных мышц человека
- 1.1. Классификация мышц
- Классификация по направлению мышечных волокон
- Классификация по количеству головок
- Классификация мышц по их отношению к суставам
- Классификация мышц по их функции
- Классификация мышц по особенностям прикрепления и выполняемой функции
- 1.2. Макроструктура мышцы
- Функции соединительной ткани
- 1.3. Микроструктура мышцы
- 1.4. Строение саркомера
- Строение толстого филамента
- Строение тонкого филамента
- 1.5. Теория скользящих нитей
- 1.6. Типы скелетных мышечных волокон и их морфофункциональная характеристика
- Рекомендуемая литература
Архитектура скелетных мышц
В первой лекции по дисципли не «Биомеханика мышц» для студентов НГУ им. П.Ф.Лесгафта рассмотрена архитектура скелетных мышц. Архитектура скелетных мышц раскрывает состав и строение мышечного волокна, миофибриллы, саркомера, толстого и тонкого филаментов. В лекции описана теория скользящих нитей, описывающая процесс сокращения саркомера, а также свойства и особенности мышечных волокон различных типов.
Лекция 1
Архитектура скелетных мышц человека
1.1. Классификация мышц
Существуют различные классификации скелетных мышц: по форме и размерам, по направлению волокон, по функции, по отношению к суставам.
Классификация по направлению мышечных волокон
Для конечностей наиболее типичны веретенообразные и перистые мышцы. Если волокна проходят параллельно продольной оси мышцы, она называется веретенообразной. Если мышечные волокна располагаются под углом к продольной оси мышцы, она называется перистой.
Из-за существования мышц с различным ходом мышечных волокон в анатомии, физиологии и биомеханике мышц утвердились понятия анатомического и физиологического поперечников.
Если произвести разрез мышцы в плоскости, перпендикулярной линии, соединяющей ее начало и конец (длиннику мышцы), и измерить площадь полученной фигуры (площадь поперечного сечения мышцы), то получим значение анатомического поперечника.
Если произвести разрез мышцы в плоскости, перепендикулярной ходу мышечных волокон, и измерить площадь полученных фигур, то сумма площадей будет характеризовать значение физиологического поперечника мышцы.
Анатомический поперечник у веретенообразной мышцы совпадает с ее физиологическим поперечником, в то время как у мышцы перистой физиологический поперечник больше анатомического.
Классификация по количеству головок
Некоторые мышцы имеют несколько головок. Такие мышцы называют соответственно числу головок двуглавыми, трехглавыми и т.д.
Классификация мышц по их отношению к суставам
Мышцы делят на группы по их отношению к суставам. Односуставные мышцы оказывают действие на один сустав. Если мышца перекидывается через два или более суставов, она называется двусуставной или многосуставной.
Возле двуосного сустава мышцы группируются соответственно двум его осям движения (сгибание — разгибание, приведение — отведение). К шаровидному суставу, имеющему три оси движения, мышцы прилежат с нескольких сторон и действуют на него в разных направлениях. Так, например, у плечевого сустава имеются мышцы-сгибатели и разгибатели, осуществляющие движения вокруг фронтальной оси, отводящие и приводящие мышцы — вокруг сагиттальной оси и мышцы-вращатели – вокруг продольной оси.
Классификация мышц по их функции
В зависимости от функции различают мышцы-синергисты и мышцы-антагонисты. Как правило, на каждый сустав в одном направлении действует две или более мышц. Такие содружественные по направлению действия мышцы называют синергистами. Мышцы, действующие на сустав в противоположном направлении (сгибатели и разгибатели), являются антагонистами.
Классификация мышц по особенностям прикрепления и выполняемой функции
П.Ф. Лесгафтом (1905) предложена классификация мышц в зависимости от их морфометрических характеристик П.Ф. Лесгафт различал мышцы сильные и мышцы ловкие. Он писал: « …мышцы по преимуществу сильные начинаются и прикрепляются к большим поверхностям, удаляясь по мере увеличения поверхности прикрепления от опоры рычага, на которой он действует; физиологический поперечник таких мышц относительно мал, несмотря на что они могут проявить большую силу при небольшом напряжении, почему и не так легко утомляются. Они действуют преимущественно всею своею массою и не могут производить мелких оттенков при движении; силу свою они проявляют с относительно малою скоростью и состоят чаще всего из коротких мышечных волокон. Мышцы второго типа, отличающиеся ловкостью в своих действиях, начинаются и прикрепляются на небольших поверхностях, близко к опоре рычага, на который действуют; физиологический поперечник их относительно велик, они действуют с большим напряжением, скорее утомляются, состоят чаще всего из длинных волокон и могут действовать отдельными своими частями, производя различные оттенки движений. Это будут мышцы, допускающие главным образом ловкие и быстрые движения».
1.2. Макроструктура мышцы
Основными структурными элементами скелетной мышцы являются мышечные волокна и соединительнотканные элементы, выполняющие в мышце вспомогательные функции.
Мышечные волокна, объединенные в пучки, формируют брюшко мышцы, переходящее в сухожилие. Окончания мышечных волокон «специализируются» в передаче силы сухожилию. Мышечные волокна по мере приближения к сухожилию значительно сужаются, и диаметр их уменьшается почти на 90%. Сужение волокон придает брюшку мышцы его типичную веретенообразную форму. На конце каждого волокна имеются складки. Они обеспечивают распределение сократительной силы на большей площади, тем самым, снижая нагрузку на поверхность волокна. Кроме того, передача силы под углом обусловливает сдвигающую нагрузку на соседние структуры.
Сухожилия состоят из плотной волокнистой соединительной ткани, богатой коллагеновыми волокнами, формируются как продолжение внутримышечных соединительнотканных элементов и вплетаются в надкостницу. Сухожилие снаружи покрыто футляром из плотной волокнистой соединительной ткани. В соединительнотканных прослойках проходят кровеносные сосуды и нервы. Сухожилие мало растяжимо, обладает значительной прочностью и выдерживает огромные нагрузки. Более подробно о механических свойствах сухожилия будет рассказано в третьей лекции.
Скелетные мышцы имеют определенные особенности прикрепления к костям. Проксимальный отдел мышцы начинается от одной кости – это начало мышцы. Дистальный конец – сухожилие – прикрепляется к другой кости – это прикрепление мышцы. При сокращении мышцы один ее конец остается неподвижным (фиксированная точка), другой изменяет свое положение (подвижная точка). Иногда фиксированная и подвижная точки меняются местами.
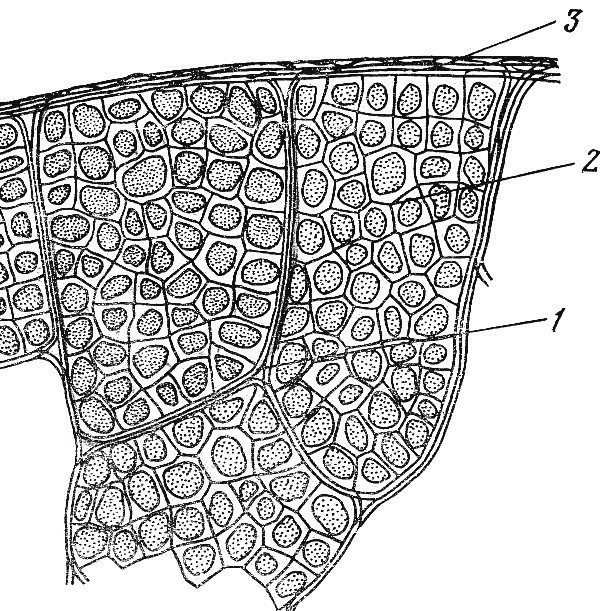
Соединительно-тканные оболочки. Поперечный разрез брюшка мышцы свидетельствует о его сложной структуре. Снаружи мышца окружена плотной соединительной тканью — эпимизием. Эпимизий состоит из пучков коллагеновых волокон. Разрезав эпимизий можно увидеть пучки мышечных волокон как бы «завернутых» в оболочку соединительной ткани. Эта соединительнотканная оболочка называется перимизий. Перимизий также достаточно плотный и относительно толстый. Разрезав перимизий, можно увидеть отдельные мышечные волокна, окруженные рыхлой соединительною тканью. Эта оболочка называется эндомизий (рис.1.1).
Рис. 1.1. Соединительнотканные структуры мышцы (В.С. Гурфинкель, Ю.С. Левик, 1985): 1 – перимизий;
2 –эндомизий, 3 – эпимизий
Фасции представляют собой соединительнотканные футляры для мышц. Они отделяют мышцы друг от друга, создают опору для мышцы при ее сокращении, служат местом начала для некоторых мышц.
Строение фасций зависит от функций мышц, давления, которое мышцы оказывают на фасции при своем сокращении. В тех местах, где мышцы много работают, фасции хорошо развиты, плотные, подкреплены сухожильными волокнами и по внешнему виду напоминают тонкое, широкое сухожилие (широкая фасция бедра, фасция голени).
Функции соединительной ткани
1. В процессе развития соединительная ткань выполняет функцию каркаса (мягкого скелета мышцы), на котором фиксируются мышечные волокна. После завершения развития мышц соединительная ткань продолжает удерживать их вместе и во многом определяет структуру мышечного брюшка.
3. Соединительная ткань противостоит пассивному растяжению мышцы и обеспечивает такое распределение сил, при котором вероятность повреждения мышечных волокон сводится к минимуму. Кроме того, свойство эластичности, обусловленное эластиновыми фибриллами и коллагеновыми пучками, позволяет брюшку восстановить свою форму после устранения действия пассивных сил.
4. Посредством эндомизия часть силы, развиваемой мышечным волокном передается сухожилию.
1.3. Микроструктура мышцы
Рассмотрим подробно строение основного структурного элемента мышцы – мышечного волокна.
Поперечнополосатая (скелетная) мышца образована расположенными параллельно друг другу мышечными волокнами длиной от 4 см и более и толщиной до 0,1 мм. Каждое волокно имеет цилиндрическую форму, покрыто двумя оболочками: базальной мембраной и сарколеммой. Между оболочками мышечного волокна находятся клетки-сателлиты. Внутри волокно заполнено гелеобразным содержимым — саркоплазмой. В саркоплазме находятся: миофибриллы, ядра, митохондрии, рибосомы, лизосомы и др. Каждая миофибрилла как муфтой окружена саркоплазматическим ретикулумом. В нем находятся ионы Са 2+ . В сарколазме также содержится белок миоглобин, который, подобно гемоглобину, может связывать 02. В зависимости от количества миоглобина в мышечных волокнах различают так называемые красные и белые мышечные волокна.
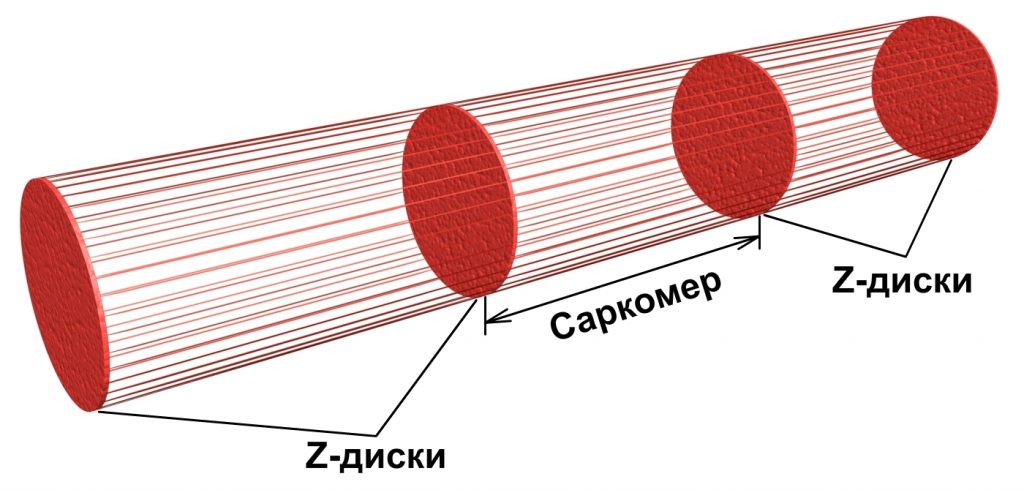
Миофибриллы являются основными сократительными элементами мышцы. Их внешний вид можно сравнить со стеблем бамбука. Длинные участки — это саркомеры, а промежутки между ними — Z-диски, рис.1.2.
1.4. Строение саркомера
Участок миофибриллы между двумя Z-дисками называется саркомером. В обе стороны от Z-диска отходят тонкие филаменты, а в середине саркомера находятся толстые нити. В определенных участках саркомера толстые и тонкие нити перекрываются. Этому участку соответствует темный диск, в то время, как в районе светлого диска находятся только актиновые нити. Средняя часть диска темного диска более светлая; она называется Н зоной, и, в свою очередь, подразделяется надвое линией М, которая делит миозиновые нити на две равные части. Поперечный разрез миофибриллы свидетельствует о том, что в соте вокруг одного толстого филамента размещаются шесть тонких филаментов. Однако в саркомере таких сот много. Расчеты показывают, что в одном саркомере диаметром 1 мкм содержится 1261 толстый филамент и 5292 тонких филаментов. При увеличении площади саркомера отношение количества тонких филаментов к количеству толстых уменьшается с 12 (12 тонких филаментов на один толстый) до 4,19 (5292 тонких на 1261 толстый), если диаметр саркомера достигает 1 мкм.
Строение толстого филамента
Основным структурным элементом толстого филамента является белок миозин. Молекула миозина состоит из двух частей: длинного палочкообразного участка («хвоста») и присоединенного к одному из его концов глобулярного участка, который представлен двумя одинаковыми «головками». Молекулы миозина расположены в толстом филаменте таким образом, что головки регулярно распределяются по всей ее длине, кроме небольшого срединного участка, где их нет («голая» зона), рис.1.3.

Строение тонкого филамента
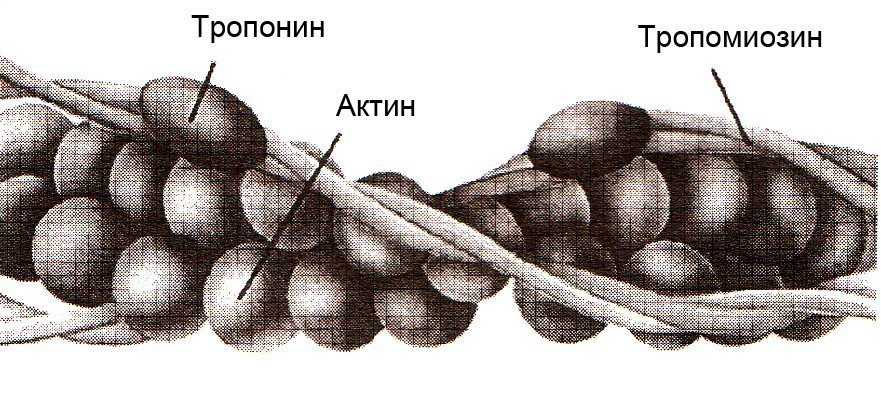
Каждый тонкий филамент образован двумя спиральными нитями из молекул актина, закрученными один вокруг другого и двух вспомогательных белков тропомиозина и тропонина. Оба вспомогательных белка (тропомиозин и тропонин) подавляют взаимодействие актина с миозином в отсутствии ионов кальция, рис.1.4.
Рис. 1.4. Тонкий филамент, состоящий из молекул актина, тропомиозина и тропонина (Дж.Х. Уилмор, Д.Л. Костилл, 1997)
1.5. Теория скользящих нитей
Способ сокращения волокон скелетной мышцы был определен в результате двух различных исследований, проведенных в начале 1950-х годов при участии ученых Эндрю и Хью Хаксли. В то время, когда Хью Хаксли проводил свои исследования при помощи электронного микроскопа, Эндрю Хаксли использовал интерференционный микроскоп для изучения характеристик мышечных волокон лягушки во время сокращения и расслабления. Он обнаружил, что во время сокращения светлый диск становился короче, тогда как длина темного диска не изменялась; в то же время бледная Н-зона в темном диске сужалась и могла вообще исчезнуть. Оба ученых независимо друг от друга выдвинули предположение, что полученные ими результаты можно объяснить скользящим движением филаментов актина и миозина относительно друг друга. Теория скольжения филаментов сегодня является общепризнанной. Кратко ее сущность состоит в следующем.
Установлено, что во время сокращения (укорочения) саркомера длина тонкого и толстого филаментов не меняется. При этом неизменной особенностью сокращения является центральное положение толстого филамента в саркомере, посередине между Z-дисками. При поступлении по аксону мотонейрона нервного импульса нервные окончания выделяют нейромедиатор – ацетилхолин, который «привязывается» к рецепторам сарколеммы. При достаточном его количестве электрический заряд передается по всей длине мышечного волокна. Этот процесс называется развитием потенциала действия. Кроме деполяризации мембраны мышечного волокна, электрический импульс проходит через сеть трубочек волокна (Т-трубочки и саркоплазматический ретикулум) во внутреннюю часть клетки. Поступление электрического импульса приводит к выделению значительного количества ионов Са 2+ в саркоплазму. Следует заметить, что концентрация ионов Са 2+ в саркоплазматическом ретикулуме выше, чем в саркоплазме. После этого ионы Са 2+ связываются с тропонином, который начинает процесс сокращения, «поднимая» молекулы тропомиозина с активных участков актиновых филаментов.
Миозин в покое неактивен, так как на его головке находится отрицательно заряженный комплекс Mg, ATФ, не позволяющий белку проявлять АТФ-азные свойства. После поступления ионов Са 2+ происходит нейтрализация заряда на головке, что приводит миозин в возбужденное состояние. После этого миозиновые головки начинают прикрепляться к активным участкам тонкого филамента.
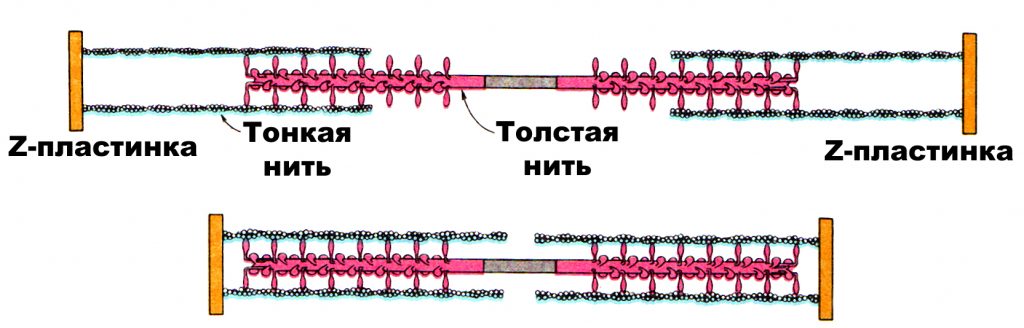
Когда миозиновая головка толстого филамента прикрепляется к тонкому филаменту, между толстым и тонким филаментами образуется поперечный мостик. При взаимодействии с актином каждая миозиновая молекула ежесекундно гидролизует до 10 молекул АТФ. За счет энергии, высвобождающейся при расщеплении АТФ, миозиновая головка поворачивается, что приводит к скольжению толстого и тонкого филаментов относительно друг друга. В конце гребка (поворота) к миозиновой головке присоединяется новая молекула АТФ, что приводит к отделению головки от актина и присоединению к новому активному участку тонкого филамента до тех пор, пока миозиновые головки не достигнут Z-диска. Так как при сокращении саркомера расстояние между Z-дисками уменьшается, происходит уменьшение его длины. Одновременное сокращение всех саркомеров приводит к уменьшению длины миофибриллы и мышечного волокна. Ввиду того, что саркомер представляет собой не плоскую, а объемную структуру, при его сокращении происходит не только уменьшение его длины, но и увеличение его поперечного сечения (когда тонкие нити втягиваются в толстые), поперечного сечения мышечных волокон и всей мышцы. рис.1.5.
Рис. 1.5. Схема, иллюстрирующая взаимодействие толстого и тонкого филаментов (Л. Страйер, 1985)
Прекращение нервного импульса приводит к расщеплению ацетилхолина и разрыву поперечных мостиков между актином и миозином. Благодаря действию «кальциевого насоса» ионы Са 2+ возвращаются в саркоплазматический ретикулум, актин и миозин инактивируются, длина саркомера возвращается к исходному значению. Мышца расслабляется. Мышечное сокращение может продолжаться до тех пор, пока не истощатся запасы ионов кальция. Затем они снова перекачиваются в саркоплазматический ретикулум посредством активной системы «кальциевого насоса». Следует отметить, что для осуществления этого процесса необходима энергия АТФ.
Каким образом доставляется энергия к филаментам? Кроме участка для прикрепления к тонкому филаменту, миозиновая головка содержит участок, в котором локализуется АТФ. Освобождающая вследствие реакции гидролиза (расщепления АТФ) энергия используется для прикрепления миозиновой головки к тонкому филаменту, а после осуществления поворота головки – для отделения миозиновой головки от тонкого филамента.
1.6. Типы скелетных мышечных волокон и их морфофункциональная характеристика
Рассматривая макроструктуру скелетных мышц, были выделены три основных элемента: это фасции, мышечные волокна и сухожилия. В этом параграфе мы более подробно рассмотрим типы мышечных волокон, так как от этого во многом зависит способность мышц к проявлению силы, скорости, а также выносливости.
Вначале были выделены два типа скелетных мышечных волокон, каждый из которых имел свои физиологические особенности. Это – медленные (тонические) и быстрые (фазические) волокна. В некоторых мышцах могут быть только быстрые или только медленные волокна, в других – волокна обоих типов в определенном соотношении. В дальнейшем были выделены мышечные волокна промежуточного типа.
Благодаря различным типам волокон организм способен передвигаться и поддерживать позу. Быстрые волокна позволяют мышце сокращаться с высокой скоростью. В большом количестве эти волокна имеются у хищников; они обеспечивают быстроту реакции при ловле добычи. С другой стороны, потенциальная добыча, чтобы не стать жертвой хищников, тоже должна быть способна к быстрому реагированию. В обоих случаях от подвижности животного будут зависеть его шансы на выживание. Когда животное находится в покое, оно поддерживает определенную позу с помощью тонических мышечных волокон. Им свойственно более медленное и длительное сокращение и в то же время энергетические затраты меньше, чем при сокращении быстрых волокон. Сокращение их по своей природе обычно изометрическое, при котором мышцы, противодействуя силе тяжести и удерживая конечности в определенном положении, сохраняют постоянную длину.
У человека все мышцы тела состоят из волокон трех типов, но обычно один из них доминирует. Это имеет физиологическое значение, поскольку тонические мышцы способны к медленному и длительному сокращению и поэтому медленных волокон больше в позных мышцах-разгибателях, тогда как в сгибателях, предназначенных для быстрых реакций, преобладают быстрые фазические волокна.
Согласно современным представлениям, большинство скелетных мышц человека и животных представляют собой гетерогенные морфофункциональные системы, состоящие из мышечных волокон, отличающихся по структуре, метаболизму и функции.
Мышечные волокна I типа в мировой номенклатуре обозначают как красные, окислительные, медленные, устойчивые к утомлению. В мышечных волокнах I типа хорошо выражен Z-диск, который толще, чем в мышечных волокнах других типов, саркоплазмаческий ретикулум развит в меньшей степени, чем в других типах мышечных волокон. В данных структурах выявляется много митохондрий с поперечной ориентацией. В саркоплазме обнаруживаются липидные капли, которые часто контактируют с митохондриями. Мышечные волокна I типа характеризуются также высокой степенью кровообращения. Каждое мышечное волокно I типа контактирует с 5-6 кровеносными капиллярами. В этих волокнах отмечается самое высокое содержание миоглобина. Согласно данным гистохимических исследований, в волокнах I типа обнаруживается более низкая активность креатинфосфокиназы, чем в других мышечных волокнах.
Мышечные волокна IIВ типа в мировой номенклатуре обозначают как белые, быстрые, гликолитические, быстроутомляемые. Z-диск в мышечных волокнах IIВ типа более тонкий, чем в волокнах других типов. В данных структурах очень хорошо развит саркоплазматический ретикулум, системы терминальных цистерн и триад. В саркоплазме мышечных волокон IIB типа сравнительно немного малых по размерам митохондрий, содержащих небольшое число крист. Мышечные волокна IIВ типа контактируют с меньшим количеством капилляров, чем мышечные волокна других типов. Кроме того, в этих волокнах имеется очень мало миоглобина. Именно этим объясняется их более светлая окраска, благодаря чему они и получили название «белых». В мышечных волокнах IIB типа содержание креатинфосфата выше, чем в других типах мышечных волокон.
Мышечные волокна IIA типа в мировой номенклатуре обозначают как промежуточные, окислительно-гликолитические, быстрые, устойчивые к утомлению. Z-диск в мышечных волокна IIA типа, по мнению ряда авторов, толще, чем в мышечных волокнах IIВ типа и не отличается от такового в волокнах I типа. По данному показателю волокна типа IIA занимают промежуточное положение между мышечными волокнами I типа и мышечными волокнами IIB типа. В мышечных волокнах IIA типа хорошо развит саркоплазматический ретикулум и системы триад. Мышечные волокна IIА типа богаче митохондриями, чем волокна IIВ типа и практически не отличаются по этому признаку от мышечных волокон I типа. Митохондрии в мышечных волокнах IIA типа имеют преимущественно продольную ориентацию (по длине оси мышечных волокон). Они часто образуют скопления под сарколеммой. В саркоплазме мышечных волокон IIA типа встречается достаточно большое количество липидных капель. Мышечные волокна IIА типа содержат больше миоглобина, чем мышечные структуры IIВ типа. Содержание креатинфосфата в мышечных волокнах IIА типа ниже, чем в волокнах IIВ типа и не отличается от такового в волокнах I типа. Мышечные волокна данного типа представляются универсальными в плане их метаболизма. В связи с тем, что мышечные волокна IIА типа способны длительное время производить работу достаточно большой мощности, они должны рассматриваться как универсальные мышечные волокна в плане их функциональных возможностей.
Рекомендуемая литература
2. Самсонова А.В. Биомеханика мышц: учебно-методическое пособие /А.В.Самсонова, Е.Н. Комиссарова / Под ред А.В.Самсоновой .- СПб., 2008.- 217 с.
Источник