Российские ученые запатентовали способ моделирования стрессового расстройства крыс

В течение семи лет в Южно-Уральском государственном университете ведутся исследования, позволяющие ученым приблизиться к поиску эффективной терапии для пациентов с комплексным ПТСР. И проблемы, которые сопровождают ПТСР, и эффективность лекарственных препаратов исследователи проверяют в результате экспериментов на крысах.
Учеными Международной лаборатории нейрогепатологии ЮУрГУ разработана экспериментальная модель, которая позволяет воспроизвести комплексный ПТСР. Ее особенность в том, что на крыс в течение 10 дней на протяжении 10 минут воздействовали кошачьей уриной. Ученые ЮУрГУ первыми пошли по пути хронизации для формирования стрессовой обстановки. Изобретение получило патент «Способ моделирования посттравматического стрессового расстройства у лабораторных крыс».
В постстрессовый период исследователи определили концентрацию кортикостерона в крови, концентрацию гамма-аминомасляной кислоты, МАО-А, содержание норадреналина в головном мозге.
«Эта модель позволяет отследить не только поведенческие расстройства и уровень тревожности, но и рассмотреть поражения внутренних органов, сопровождающих ПТСР. Для нас было большим сюрпризом открытие, что у пациентов с этим диагнозом имеет место надпочечная недостаточность и нарушение работы сердечно-сосудистой системы. Ранее ни одна модель не отражала такой зависимости», — рассказал один из авторов патента д.б.н., директор Высшей медико-биологической школы ЮУрГУ Вадим Цейликман.
Модель уже зарекомендовала себя в университетах России, Белоруссии и Словакии. В будущем коллеги из других городов и стран смогут пользоваться моделью при проведении исследований совместно с учеными ЮУрГУ. По словам Вадима Цейликмана, исследователи заинтересованы в том, чтобы их изобретение получило широкое распространение.
Южно-Уральский государственный университет (ЮУрГУ) — это университет цифровых трансформаций, где ведутся инновационные исследования по большинству приоритетных направлений развития науки и техники. В соответствии со стратегией научно-технологического развития РФ университет сфокусирован на развитии крупных научных междисциплинарных проектов в области цифровой индустрии, материаловедения и экологии. В Год науки и технологий ЮУрГУ примет участие в конкурсе по программе «Приоритет-2030». Вуз выполняет функции регионального проектного офиса Уральского межрегионального научно-образовательного центра мирового уровня (УМНОЦ).
Пресс-релиз предоставлен управлением медиакоммуникаций и мониторинга ЮУрГУ
Источник
Модели стресса у крыс
Важным проявлением стресс-реакции и адапционной перестройки является совершенствование деятельности регуляторных механизмов, участвующих в поддержании оптимального уровня интенсивности обменных процессов на уровне целостного организма [9]. При этом, несомненно, должны существовать органоспецифические особенности в осуществлении мобилизации различных механизмов при стрессе, и проблема реализации стресс-реакции на уровне отдельных органов и тканей остается актуальной [11]. В частности, малоизученным остается вопрос об изменениях метаболических процессов при развитии стресс-реакции. Как известно, одним из ведущих повреждающих факторов при стрессе, детерминирующих развитие вторичных изменений органов и тканей, является интенсификация свободнорадикального окисления, которая наряду с этим рассматривается как один из универсальных физиологических процессов – окисление биологических субстратов при действии АФК [6, 1, 5]. Анализ современной научной литературы позволяет прийти к заключению о том, что значительное количество работ посвящено ПОЛ, в том числе стресс-индуцированному, при этом окислительной деструкции белков клеток и тканей уделяется меньшее внимание [5, 11, 12]. Механизмы и последствия стресс-реакции в организме зависят не только от метаболических возможностей различных тканей, но и от возраста индивидуума. В то же время, возрастной аспект исследования свободнорадикальной деструкции белковых и липидных компонентов тканей, незначительно представленный в литературе, должен дополнить известные к настоящему времени закономерности стресс-реакции на разных этапах онтогенеза и позволит существенно углубить представления о возрастных особенностях механизмов адаптации к экстремальным, стресс-индуцирующим воздействиям [3,4,10]. Цель настоящего исследования состояла в изучении возрастных и тканеспецифических особенностей
перекисного окисления белков и липидов у крыс разных возрастных групп при остром эмоционально-болевом стрессе.
Материалы и методы исследования
Исследования проводились на белых крысах-самцах в трех сериях опытов на 3-х возрастных группах животных: 1 – неполовозрелые 7 – недельного возраста массой 64 г; 2 – половозрелые животные 4-месячного возраста, средней массой 153 г.; 3 – старые животные 18-месячного возраста, средней массой 385 г, всего 84 животных. Животные были разделены на следующие группы:
1) интактные животные (контроль),
2) животные, подвергавшиеся эмоционально-болевому стрессу.
Животные содержались в стандартных условиях вивария при естественном освещении и свободном доступе к воде и корму. По окончании опытов животных декапитировали после предварительной наркотизации крыс внутрибрюшинным введением нембутала в дозе 4 мг/100 г массы тела. Моделью эмоционально-болевого стресса служило электрокожное раздражение, для чего использовали прямоугольную камеру с решетчатым металлическим полом, соединенным с источником переменного тока фиксированного сопротивления, получаемого с помощью лабораторного автотрансформатора. Крысу помещали в установку на 5 мин. для ознакомления с ней, а затем подавали электрический ток с напряжением 40 V на протяжении 15 мин. с интервалом 30 сек. Животных забивали сразу после извлечения из камеры. После декапитации забирали кровь, выделяли большие полушария и гипоталамус, вскрывали грудную и брюшную полость и отпрепаровывали легкие, сердце и печень для последующей гомогенизации, экстрагирования тканей и биохимического анализа. Уровень свободнорадикального окисления определяли по скорости перекисного окисления липидов и перекисного окисления белков (ПОБ) в крови, а также гомогенатах больших полушарий, гипоталамусе, печени, легких и миокарде. Для определения перекисного окисления белков использовали методику Дубининой Е.Е., Бурмистрова С.О., Леоновой Н.В. (1995) [2]. Перекисное окисление липидов в гомогенатах тканей оценивали по скорости спонтанного и неферментативного аскорбатзависимого ПОЛ, содержанию в тканях конечного продукта ПОЛ – малонового диальдегида [8]. Весь экспериментальный материал обрабатывался статистически с вычислением средней арифметической, ошибки средней, достоверности различий по критерию Стьюдента и проведением дисперсионного анализа с вычислением достоверности силы влияния по Фишеру [7].
Результаты исследования
и их обсуждение
При анализе полученных в ходе экспериментов данных у интактных животных разного возраста нами обнаружены как онтогенетические, так и тканеспецифические особенности пероксидного окисления как белковых компонентов тканей так и липидной пероксидации. Результаты исследований представлены в табл. 1, 2.
Уровень перекисного окисления липидов в висцеральных тканях крыс разного постнатального возраста в условиях эмоционально-болевого стресса (M ± m)
Источник
Модели стресса у крыс
Хронический стресс многими исследователями рассматривается в качестве одной из причин, способствующих развитию таких широко распространённых в мире патологий, как метаболический синдром, диабет 2-го типа, воспалительное заболевание кишечника [1, 2]. В связи с этим большой теоретический и практический интерес представляют исследования, которые направлены на выявление метаболических нарушений, вызванных хроническим стрессом.
В последние годы эффекты хронического стресса в отношении пищеварительной системы, обеспечивающей начальные этапы метаболизма пищевых веществ, широко изучались как на клиническом уровне, так и в модельных опытах на животных. Показано, что для хронического стресса характерно образование язв в желудке и двенадцатиперстной кишке [3], раннее появление признаков воспаления в кишечнике [2] и изменение ряда его функциональных параметров (моторика, кровоток, пассивная проницаемость эпителия) [2]. Вместе с тем до сих пор остаётся недостаточно изученным вопрос о возможном действии хронического стресса на мембранное пищеварение, обеспечивающее заключительные стадии гидролиза пищевых веществ, а также на систему всасывания глюкозы.
Цель настоящей работы состояла в том, чтобы в опытах на крысах, как экспериментальной модели, оценить влияние хронического умеренного стресса, вызванного ежедневной 3-часовой иммобилизацией животных на протяжении 3–16 дней, на активность ряда мембранных пищеварительных ферментов (глюкоамилаза, щелочная фосфатаза, аминопептидаза N) и на всасывание глюкозы в тонкой кишке.
Материалы и методы исследования
Эксперименты проводились на 48 взрослых крысах (Вистар, самцы, масса тела 180 – 220 г) в полном соответствии с Директивой Европейского Совета (The European Council Directive (86/609/EEC)) по соблюдению этических принципов в работе с лабораторными животными и одобрены Комиссией по контролю за содержанием и использованием лабораторных животных при ФГБУН Институт физиологии им. И.П. Павлова РАН.
Перед опытами и в ходе их проведения (за исключением периодов с 3-часовой иммобилизацией крыс опытных групп) животные содержались в нормальных условиях в отношении температуры и освещения, а также имели свободный доступ к стандартному лабораторному корму и воде.
Уровень всасывания глюкозы в тонкой кишке оценивался с использованием разработанной нами ранее методики [4], основанной на существовании высокой степени корреляции между скоростью свободного потребления животными, предварительно голодавшими 18–20 ч, концентрированных растворов глюкозы и способностью тонкой кишки к ее всасыванию.
В предварительных опытах в течение 5–6 ч у всех крыс регистрировалась временнaя динамика свободного потребления ими раствора глюкозы (200 г/л). Для этого каждое животное после предварительного голодания в течение 18–20 ч помещали в индивидуальную клетку размером 14х21х11 см с двумя мерными поилками, в одной из которых содержался раствор глюкозы в концентрации 200 г/л, а в другой – обычная вода. Однако следует отметить, что на протяжении всего опыта крысы пили только раствор глюкозы. По данным проведенных измерений методом линейной регрессии с использованием программного ресурса «ORIGIN 7» (OriginLabCorporation, USA) для каждого из животных определялось среднее значение объемной скорости (мкл/мин) потребления этого раствора во временном интервале от 60 до 300–360 мин, когда, как показали наши предшествующие исследования [4], эта скорость относительно постоянна. На основе результатов, полученных в нескольких предварительных опытах, было сформировано шесть групп крыс (три – опыт и три – контроль) с близкими средними значениями скоростей потребления раствора.
Животных из опытных групп ежедневно подвергали трёхчасовой иммобилизации в отдельных специальных клетках, частично ограничивающих их подвижность, а у контрольных – на 3 часа отбирали корм. Этот вид стрессорного воздействия является моделью умеренного психологического и физического стресса [1]. Опыты с иммобилизацией проводили в дневное время с 10:00 до 13:00.
Уровень всасывания глюкозы в тонкой кишке у всех животных (опытных и контрольных) оценивали через 3, 10 и 16 дней от начала опытов со стрессом в интервале 10:00 и 15:00 ч (в период неактивной фазы питания у крыс). В эти же сроки (по окончании опыта с регистрацией потребления глюкозы) у части опытных и контрольных животных после их декапитации отбирались пробы слизистой оболочки из различных отделов тонкой кишки для определения в них активности пищеварительных ферментов: глюкоамилазы (НФ 3.2.1.3), щелочной фосфатазы (НФ 3.1.3.1) и аминопептидазы N (НФ 3.4.11.2) с использованием общепринятых биохимических методов [5]. При этом для каждого фермента рассчитывались значения как удельной (мкмоль/мин на г ткани), так и интегральной активности с учётом массы слизистой оболочки (мкмоль/мин на участок тонкой кишки или мкмоль/мин на всю кишку). Поскольку при разных вариантах расчётов наблюдались близкие закономерности в изменении ферментативных активностей, в статье приведены лишь данные в отношении интегральной активности (мкмоль/мин на всю кишку).
Кроме того, у некоторых животных из опытных и контрольных групп (n = 6) в 1-й, 4-й, 10-й и 16-й дни опытов через 30 мин после начала стрессорного воздействия из хвостовой вены отбирались пробы крови для определения в них концентрации кортикостерона. Определение проводилось путем иммуноферментного анализа с использованием набора реагентов «Кортикостерон крыса/мышь-ИФА» фирмы ХЕМА в соответствии с инструкцией, приложенной к набору.
Статистическая обработка результатов проводилась с использованием t-критерия Стъюдента. За достоверные принимались различия при P
Источник
Модели стресса у крыс
Посттравматическое стрессовое расстройство (ПТСР) является единственным серьезным психическим расстройством, имеющим определенное этиологическое происхождение – травматическое событие, которое предполагает опасное для жизни воздействие, угрозу физической целостности себя и окружающих, и вызывает состояние сильного страха, беспомощности или ужаса [5, 6]. Люди, у которых развилось ПТСР вследствие психотравмирующих ситуаций, таких как военные действия, сексуальное или физическое насилие, стихийные бедствия, транспортные аварии, испытывают хронический психологический стресс, что может приводить к формированию поведенческих и психических отклонений [1, 4]. Постоянное переживание своих травм через навязчивые, возвращающиеся воспоминания, избегания мест и людей, напоминающих травмирующее событие, нервозность и ночные кошмары существенно мешают повседневной жизни и способствуют развитию коморбидных состояний [10].
К настоящему времени механизмы развития ПТСР остаются неясными. Собрано большое количество данных нейровизуализации и клинических исследований о конкретных структурных и функциональных изменениях в мозге пациентов и животных с ПТСР. Среди обнаруженных нарушений отмечают гиперактивацию миндалины, сокращение объема областей префронтальной коры и гиппокампа [5, 6]. При этом самыми повторяющимися нарушениями, коррелирующими с развитием ПТСР, являются патологическая морфология и снижение объема гиппокампа, а также повышение нейронального апоптоза в данной области [4, 5]. С другой точки зрения, уменьшение объема гиппокампа больше связано с самим травмирующим воздействием, чем с наличием или интенсивностью ПТСР [8]. Таким образом, несмотря на проведенные ранее исследования, вопрос о том, является ли структурное изменение объема гиппокампа биомаркером наличия ПТСР или предрасположенностью к его развитию, остается открытым [6, 10].
Экспериментально применять в исследованиях на людях стресс-факторы, способные вызвать ПТСР, этически недопустимо, поэтому при изучении механизмов развития данной патологии широко используют животные модели [2, 4]. Существуют различные животные модели формирования ПТСР, которые предполагают воздействие травматического стресса на животных с последующим исследованием системных и молекулярных механизмов влияния стресса на центральную нервную систему. Сроки изучения развития отклонений и изменений после индуцирования тревожного расстройства могут быть различными в зависимости от исследуемой структуры мозга (от получаса до нескольких месяцев). В целом, применение животных моделей тесно связано с проблемой адекватного моделирования тревожного расстройства на разных линиях крыс и воспроизводимостью результатов поведенческого фенотипирования [2, 7].
Цель данного исследования состояла в моделировании ПТСР у нелинейных крыс дикого типа и выявлении возможных структурных изменений в области гиппокампа на раннем сроке (10 дней) после формирования состояния тревожного расстройства.
Материалы и методы исследования
Объект исследования
Для изучения структурных изменений гиппокампа в поведенческой модели ПТСР были сформированы контрольная и экспериментальная группы животных, по семь особей в каждой (нелинейные крысы, самцы; масса тела 180–200 г, возраст – 1,5–2 месяца). Животных содержали в стандартных клетках по две крысы в каждой, при свободном доступе к пище и воде, световом режиме 12С:12Т и температуре 21 ± 2 °С.
Моделирование посттравматического стрессового расстройства
Для формирования у крыс симптомов, аналогичных при ПТСР, применяли модель «стресс-ресстрес» [1, 9] с внесением модификации. Модель включала два этапа: тяжелый травматический стресс (иммобилизация, вынужденное плавание, воздействие паров эфира до потери сознания) и через семь суток – напоминающий рестресс. Применяли следующий алгоритм формирования травматического стресса: иммобилизация животного в рестрейнере в течение 2 часов, вынужденное плавание в пластиковом цилиндре диаметром 20 см и высотой 50 см, заполненном водой на 1/3 (температура воды 25 °С) в течение 20 минут, 15 минут отдыха и просушивания в пустой клетке, затем помещение в камеру с эфиром до потери сознания. Через семь суток проводили рестресс, который включал последовательно 30-минутную иммобилизацию с добавлением воздействия эфиром как триггера, усиливающего развитие тревожного патологического состояния.
Поведенческое фенотипирование проводили в приподнятом крестообразном лабиринте до начала формирования тревожного расстройства и на 7-й день после стресса перед проведением рестресса, контрольную группу оценивали один раз. Лабиринт располагался над полом на высоте (60 см) и состоял из двух закрытых (50×14 см) и двух открытых (50×14 см) рукавов с открытым верхом, а также центральной области на пересечении рукавов. Крысу помещали в центральную область головой по направлению к открытому рукаву и оставляли в лабиринте на 5 мин. Поведение животного в лабиринте регистрировали на видеокамеру (GoPro, частота дискретизации 50 кадров/сек), затем видеозапись обрабатывали при помощи программы Real Timer. Регистрировали основные поведенческие характеристики, такие как время пребывания в открытых и закрытых рукавах лабиринта, в центральной области, количество заходов в открытые и закрытые рукава, количество стоек без опоры и с опорой на стенки лабиринта, груминг и замирание. Вход в рукав засчитывался по задним лапам животного, когда оно пересекало границу между центром и рукавом всем телом. После проведения теста лабиринт дезинфицировали этанолом и оставляли на 15 минут.
Измерение объема гиппокампа
После декапитации животных образцы мозгов крыс были выделены через 10 дней после воздействия травмирующего стресса и зафиксированы для приготовления гистологических срезов в 4 % параформальдегиде. Перед приготовлением срезов за 24 ч до замораживания ткани мозга крысы материал помещали в 30 % раствор сахарозы. Срезы толщиной 50 мк готовили на криостате (Leica 1850, Germany) и окрашивали в соответствии с протоколом по авидин-биотиновой методике, располагали по предметным стеклам и заключали в NewMount. Сканирование образцов выполняли на микроскопе (KEYENCE BZ-9000, Japan). Обработку полученных изображений фронтальных срезов, выделение и измерение площади области гиппокампа производили в программе ImageJ, ориентируясь на атлас (Rat Brain – Paxinos G. and Watson C.), вычисление объема проводили в Microsoft Excel 2010. Результаты представлены c использованием стандартной ошибки среднего, достоверность различий оценивали по критерию Манна-Уитни.
Результаты исследования и их обсуждение
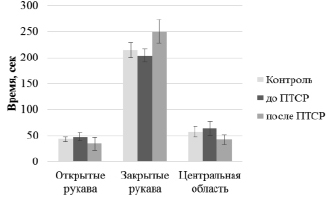
Результаты поведенческого фенотипирования экспериментальной группы крыс до и после индуцирования ПТСР по сравнению с контролем показали, что из всех рассматриваемых поведенческих характеристик наиболее показательным был критерий «время пребывания» для открытых и закрытых рукавов лабиринта, а также в центральной области. И в контрольной группе, и в экспериментальной до формирования ПТСР время, проведенное в указанных зонах крестообразного лабиринта, не различалось, что указывает на поведенческую однородность групп. После индуцирования ПТСР время нахождения в открытых рукавах и центральной области снижается, в то время как в закрытых рукавах возрастает. Различия значимы с применением стандартной ошибки среднего. Однако при использовании критерия Манна-Уитни, статистическая значимость различий не подтвердилась (рис. 1, «контроль-ПТСР», закрытые рукава, p = 0,14). Полученные нами результаты диссонируют с данными ряда исследований, в которых показано увеличение времени пребывания стрессированных крыс в центральной области, что, по мнению авторов, свидетельствует о трудностях крыс в выборе действия [2]. Такое несоответствие может иметь под собой несколько причин. Прежде всего, в исследованиях широко используют крыс линии Wistar, которые отличаются по поведению от нелинейных крыс, используемых нами: последние, возможно, обладают более мощным адаптивным потенциалом по отношению к стрессовым факторам. Кроме того, мы полагаем, что такие результаты могли быть получены из-за сокращения времени, отведенного нами на формирование ПТСР у животных, по сравнению со стандартными методиками, которые предполагают 3 недели, поскольку мы преследовали цель выяснить, насколько рано можно заметить различия в поведении у стрессированных нелинейных крыс.
Рис. 1. Время нахождения крыс в различных частях лабиринта (mean ± SEM). По горизонтальной оси указаны области крестообразного лабиринта, по вертикальной оси отмечено время нахождения животных в соответствующих областях. Легенда: «Контроль» – контрольная группа, «до ПТСР» – экспериментальная группа до формирования ПТСР, «после ПТСР» – экспериментальная группа после формирования ПТСР
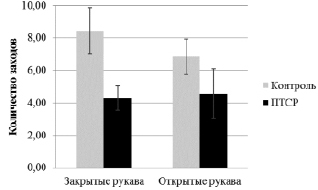
Стоит отметить, что количество заходов в рукава у крыс экспериментальной группы по сравнению с контролем значимо не изменилось, несмотря на имеющиеся различия между ними в закрытых рукавах (рис. 2, критерий Манна-Уитни, р = 0,64). Результаты показывают, что через 10 дней после травматического воздействия животные не снижают своей локомоторной активности в лабиринте, но эти данные соотносятся с исследованием [3], в котором общее количество заходов у крыс с ПТСР даже несколько выше, чем в контроле.
Рис. 2. Общая активность (количество заходов в рукава) крыс в лабиринте (mean ± SEM). Легенда: «Контроль» – контрольная группа, «ПТСР» – экспериментальная группа после формирования ПТСР
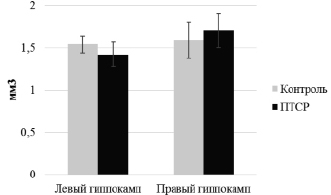
Проведенное нами морфометрическое измерение объемов, как правого, так и левого гиппокампа показало отсутствие статистически значимых различий между контрольной и экспериментальной группами, несмотря на видимые различия при использовании параметрического анализа (рис. 3, критерий Манна-Уитни p > 0,99 – для левого гиппокампа, p = 0,07 – для правого гиппокампа). Это позволяет предположить, что либо за такой короткий промежуток времени никаких изменений в объеме гиппокампа происходить не должно, либо нелинейные крысы дикого типа, которых мы использовали в эксперименте, более устойчивы к стрессорным воздействиям, и данная модель неэффективна по отношению к ним.
Рис. 3. Измерение объема гиппокампа (mean ± SEM). По вертикальной оси указан объем гиппокампа в правой и левой половине мозга (в мм3). Легенда: «Контроль» – контрольная группа, «ПТСР» – экспериментальная группа после формирования ПТСР
Заключение
Гиппокамп – одна из основных структур головного мозга, обеспечивающих реализацию механизмов памяти, поведенческих реакций, в том числе избегания стрессовых воздействий. Уменьшение объема гиппокампа отмечено в большом количестве работ, посвященных исследованию изменений структур мозга при ПТСР, которые выполнены с применением метода фМРТ [6, 7]. Полученные в нашем исследовании изменения в объеме гиппокампа не являются статистически значимыми, что, в сочетании с отсутствием достоверных изменений поведенческих характеристик и уровня тревожности у животных экспериментальной группы по сравнению с контролем, ставит под сомнение формирование ПТСР за короткий промежуток времени у нелинейных крыс. Уместно отметить, что модель «стресс-рестресс» была применена нами на крысах, имеющих значительно менее однородный генотип по сравнению с линейными лабораторными крысами, и, как следствие, усложнение протокола моделирования тревожного расстройства. Однако отмеченные различия в поведении экспериментальной группы до и после стрессирования позволяют предполагать успешность данной поведенческой модели при использовании крыс Wistar и увеличении временного периода после травматического воздействия [1–3].
Источник