Механизмы формирования чувства боли
Боль является многомерным восприятием с участием не только сенсорных параметров, но и многих других факторов, в том числе эмоций, познания, мышечных движений и других физиологических процессов.
Многоаспектный характер боли стал общепринятым понятием. Аспект восприятия — сенсорно-дискриминативные компоненты — рассматривается при этом как функция боли, обеспечивающая информацию о ее месте, продолжительности и интенсивности. Этот аспект часто играет ключевую роль в экспериментальном измерении боли, но его значение не следует переоценивать, поскольку боль носит комплексный характер. Единственной адекватной характеристикой боли может быть отношение между сенсорными и аффективными сигналами.
Не только сложность, но и субъективность восприятия боли определяет трудности ее измерения. Это породило усилия по созданию «объективной» алгезиметрии, которая не требует отчета о субъективном состоянии, но в первую очередь оценивает ответы на вредные раздражители в двигательной, вегетативной, эндокринной и центральной нервной системах. Несмотря на слабую корреляцию между субъективными и объективными параметрами восприятия боли, представляется целесообразным рассматривать боль, как многомерную и не слишком пренебрегать субъективной оценкой.
В этой связи для получения расширенной дифференцированной информации о ноцицептивной системе в нормальных и патофизиологических условиях требуется комбинация различных стимулов и подходов для оценки. Для того, чтобы более точно моделировать боль в лаборатории были разработаны модели «тонической боли». Конечной целью экспериментального измерения боли (количественного сенсорного тестирования) является более глубокое понимание механизмов, участвующих в трансдукции боли, передаче и восприятии в нормальных и патофизиологических условиях.
Будем надеяться, что это сможет обеспечить лучшую профилактику и лечение боли. Экспериментальные подходы могут быть применены в лаборатории фундаментальных исследований (центральная повышенная возбудимость или доклинический скрининг эффективности лекарственных препаратов), но и в клинике, для характеристики пациентов с сенсорными нарушениями и/или болью (например, нейрогенная боль). В последние годы для оценки эффективности новых потенциальных анальгетиков получило значительное развитие применение экспериментальной боли.
Основные преимущества количественной оценки боли в нормальных и патологических условиях:
— Интенсивность стимула, продолжительность и порядок, которые являются управляемыми, а не различными по времени
— Дифференцированные ответы на различные стимулы
— Физиологические и психофизиологические реакции, которые могут быть оценены как количественно, так и в сравнении с другими периодами
— Болевая чувствительность, которую можно сравнить количественно между различными нормальными/пострадавшими регионами
— Экспериментальные модели патологических состояний (например, гипералгезия), которые могут быть изучены.
Таким образом, экспериментальная оценка восприятия боли имеет перспективное будущее для решения клинических задач.
Ощущение острой боли является результатом активации нормальных (не сенсибилизированных) ноцицепторов, которые классифицируются как Аδ или С ноцицепторы, в соответствии с периферическими нервными волокнами, передающими нервные импульсы. В последние годы с помощью техники микронейрографии выявлено несколько классов С ноцицепторов у людей.
Ноцицепторы в коже делятся на три основные класса: С-механо-тепло, типа I Аδ-механо-и тепло, тип II Аδ-механо-тепло. Тип I Аδ-проявляется медленно растущим ответом с задержкой в несколько секунд, чтобы передать стимулы высокой интенсивности и длительности. Если кожа активируется быстрыми тепловыми раздражителями (например, от лазера), тип II Аδ-ноцицепторы активируются вместе с некоторыми рецепторами тепла (С-волокна).
Особое значение для патофизиологических механизмов может иметь нахождение молчащих ноцицепторов, которые не являются активированными нормальными или вредными стимулами, но становятся активными в состоянии альтерации, в частности, при воспалении. В случае повреждения периферического нерва, С-ноцицепторы могут стать чувствительными в связи с влиянием большого количества воспалительных веществ, выбрасываемых в месте травмы. Сенсибилизация С-ноцицепторов вызывает сенсорные изменения ограниченные этим местом, но не в окружающей ткани.
Эти сенсорные изменения, прежде всего представлены аллодинией. Аллодиния определяется как боль, появляющаяся без болезненных раздражителей (например, снижение порога вызванной теплом боли). Второе место занимает гипералгезия. Гипералгезия определяется как увеличенный ответ на стимул, который обычно умеренно болезненный.
При острой боли, формируются входящие к спинному мозгу стимулы, ноцицептивные импульсы передаются в нейроны второго порядка и затем в ЦНС. В случае повреждения периферических нервов, увеличивается количество ноцицептивных импульсов, достигающих заднего рога спинного мозга и может развиться центральная сенсибилизация. Эта центральная сенсибилизация включает в себя сложную серию событий в нейронах заднего рога.
Совокупный рост потенциалов действия в результате поцицептивной стимуляции считается первым шагом, опосредованным активацией N-метил-D-аспартат рецепторов. Теорией центральной сенсибилизации нельзя объяснить все клинические симптомы, результаты сенсорных нарушений у пациентов с хронической болью, но демонстрация центральной повышенной возбудимости оказала огромное влияние на понимание некоторых явлений, наблюдающихся у пациентов с хронической болью.
Например, аллодиния на механическое раздражение, часто встречающаяся при нейропатической боли, была объяснена центральной возбудимостью, равно как и увеличение — с течением времени — области боли. Будет ли возникновение спонтанной и пароксизмальной боли объяснено полностью или частично одними и теми же механизмами, остается нерешенным вопросом.
Традиционно клинические болевые синдромы лечатся в соответствии с этиологией (например, постгерпетическая невралгия, болезненная диабетическая невропатия). Наличие знаний о потенциальном общем нейрофизиологическом механизме в различных типах боли предполагает изменение подхода. Более целесообразным представляется оценка и лечение боли в зависимости от основного нейрофизиологического механизма—«классификация боли, основанная на механизме». Это открывает новые перспективы для будущего лечения боли со значительными изменениями разработок тестовых процедур, помогающих различать механизмы возникновения боли в клинических условиях.
Видео урок проводящие пути болевой и температурной чувствительности
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Механизмы формирования чувства боли
Согласно определению Международной ассоциации по изучению боли, боль — это неприятное чувствительное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения.
В этом определении сделан акцент на аффективном (эмоциональном) компоненте боли. Другой компонент боли — чувствительно-дискриминационый («Где и как сильно?»).
а) Периферические пути болевой чувствительности. За проведение болевых ощущений отвечают тонкие миелинизированные (А6) и немиелинизированные (С) волокна, исходящие от униполярных клеток спинномозгового ганглия. Иногда эти волокна называют «волокнами боли», хотя существуют и другие нервные волокна сравнимого диаметра, которые являются исключительно механорецепторными. В то же время другие волокна, связанные, например, с механорецепторами или терморецепторами, вызывают чувство боли только при работе на высокой частоте. В общем плане обсуждения боли последние волокна называют полимодальными ноцицепторами.
В составе спинномозговых нервов находятся дистальные отростки ганглионарных клеток, иннервирующих соматические ткани, в том числе кожу, париетальную плевру и брюшину, мышцы, суставные капсулы и кости. Проксимальные отростки отдают ветви на уровне зоны выхода задних корешков, далее в составе дорсолатерального пути Лиссауэра поднимаются вверх, пропуская пять или более сегментов спинного мозга, а затем оканчиваются в пластинах I, II и IV заднего рога. Аналогичные волокна тройничного нерва оканчиваются в спинномозговом ядре тройничного нерва.
Дистальные нервные отростки, направляющиеся от внутренних органов, имеют общую периневральную оболочку с постганглионарными волокнами симпатического ствола. Проксимальные отростки пересекаются с волокнами пути Лиссауэра и заканчиваются в этой же области. Считают, что перекрест соматических и висцеральных афферентных окончаний на дендритах центральных болевых нейронов объясняет возникновение отраженной боли при таких состояниях, как инфаркт миокарда или острый аппендицит.
б) Сенситизация ноцицепторов. При повреждении тканей из них происходит выброс различных активных веществ — брадикининов, простагландинов и лейкотриенов, которые понижают порог возбудимости ноцицепторов. При повреждении С-волокон происходит также активация аксон-рефлексов, в окружающие ткани высвобождаются субстанция Р и кальцитонин ген-связанный пептид (CGRP), стимулируя выброс гистамина тучными клетками. Гистаминовые рецепторы, которые могут располагаться на нервных окончаниях (Глава 8), способы стимулировать синтез арахидоновой кислоты за счет гидролиза мембранных фосфолипидов.
Фермент циклооксигеназа превращает арахидоновую кислоту в простагландины. (Механизм действия аспирина и других нестероидных противовоспалительных препаратов заключается в угнетении этого фермента и снижении синтеза простагландинов.)
В результате возникают длительная активация большого числа С-волокон и сенситизация механических ноцицепторов. Клинически это проявляется аллодинией, при которой даже легкое прикосновение к какой-то области вызывает болевые ощущения, и гипералгезией, когда даже незначительные болезненные стимулы воспринимают как сильнейшую боль.
Для синдрома раздраженного кишечника характерна сенситизация ноцицептивных интерорецепторов брюшной стенки. Такой механизм развития болевого синдрома характерен также для интерстициального цистита.
Сенситизация нейронов С-волокон может также происходить за счет изменения транскрипции генов, когда аномальные натриевые каналы встраиваются в клеточную мембрану нейронов заднего спинномозгового ганглия. В этом месте может возникать спонтанная электрическая активность, которая, как считают, может быть ответственна за неэффективность анальгетиков, блокирующих проведение нервного импульса на высоких уровнях.
в) Нейропатическая боль. При рассечении периферического нерва его проксимальная и дистальная культи оказываются разделенными формирующейся рубцовой тканью. На аксонах, захваченных в этой рубцовой ткани, формируются небольшие нитевидные утолщения — невромы, которые очень чувствительны к сдавлению. При их длительной активации страдания пациента усиливаются, поскольку у него развивается синдром центральной боли. Постгерпетическая невралгия — это нейропатическая боль, которая становится следствием перенесенной инфекции herpes zoster («опоясывающий лишай») и проявляется появлением везикул вдоль зоны иннервации кожного нерва, обычно межреберного.
Вирус может поддерживать боль за счет активации механизма транскрипции генов, который был описан выше. Центральные пути болевой чувствительности Центральные ноцицептивные нейроны подразделяют на две группы—специфические, с небольшой зоной периферической иннервации (около 1 см 2 ), а также имеющие широкий динамический диапазон (более 2 см 2 ). Это механические ноцицепторы, которые кодируют тактильные стимулы как импульсы низкой чистоты и болевые стимулы как импульсы высокой частоты.
Согласно общепринятому мнению, спиноталамический путь (или переднебоковой, учитывая его расположение в спинном мозге) состоит из различных волокон, которые отвечают как за различение болевых, температурных и тактильных стимулов (неоспиноталамический, или прямой, путь), так и за аффективную, двигательную и вегетативную реакции на боль (палеоспиноталамический, или непрямой, путь).
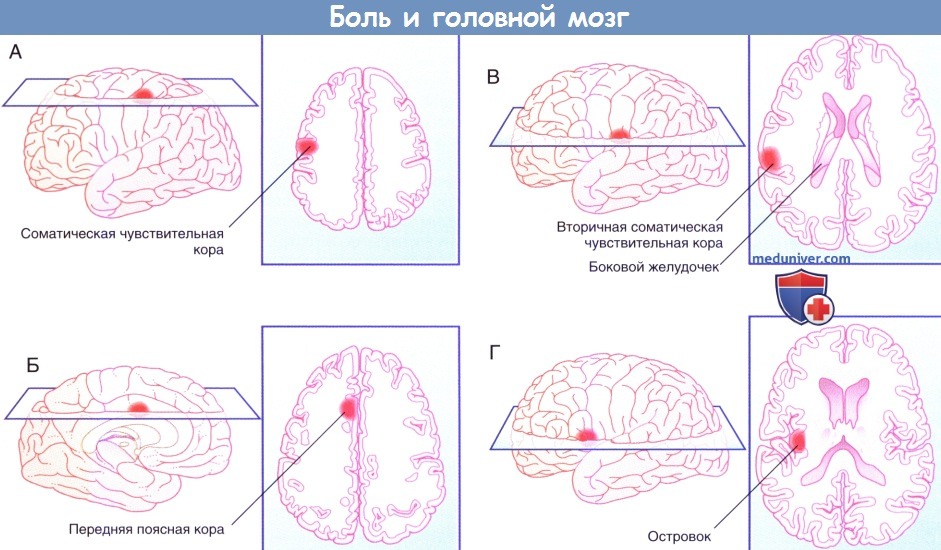
г) Прямой путь болевой чувствительности. Прямой путь для туловища и конечностей начинается от заднего рога спинного мозга и в составе спиноталамического пути направляется к задней части вентрального заднелатерального ядра таламуса с противоположной стороны. На голове и шее он начинается в спинномозговом ядре тройничного нерва и по тройнично-таламическим волокнам идет к задней части медиального ядра противоположного таламуса. Отсюда волокна преимущественно направляются к первичной соматической чувствительной коре (SI) и частично к верхней части латеральной борозды (SII). Установлена соматотопическая организация этой области, что удалось выявить при помощи проведения ПЭТ головного мозга во время воздействия теплового стимула на различные участки лица.
Благодаря исследованиям на животных обнаружили, что в SI имеются высоковозбудимые специфические ноцицептивные нейроны, рецепторное периферическое поле которых относительно невелико. Именно эти нейроны лучше всего отвечают на вопрос «Где и как сильно болит?».
На рисунках ниже изображены проекции к задней теменной коре и SII.
Понятно, что спиноталамическая система раннего оповещения отвечает за поворот глаз и головы в сторону источника боли. Спинопокрышечный путь направляется наверх вдоль спиноталамического пути и заканчивается в верхних холмиках. Он также организован соматотопически. Волокна этого пути обеспечивают работу зрительного рефлекса, который поворачивает глаза/туловище/конечности в сторону стимулируемой области. Помимо активации этого филогенетически древнего пути (он имеется уже у рептилий), зрительный путь, отвечающий на вопрос «Где?», также связан с волокнами, идущими к задней теменной коре от SI.
В SII число ноцицептивных нейронов меньше, однако они также могут получать зрительную информацию. Они связаны с островком, который получает импульсы непосредственно от таламуса. При стимуляции островка в организме возникают вегетативные реакции (повышение частоты сердечных сокращений, вазоконстрикция, потоотделение). Интересно, что при повреждении островка человек перестает воспринимать болевые стимулы как неприятные, но при этом он все еще может локализовать стимул и определять его интенсивность. Такое состояние называют асимболией боли.
д) Непрямой путь болевой чувствительности. Непрямой путь — полисинаптический, в составе спиноретикулярного и тройнично-ретикулярного путей он направляется к дорсальному медиальному ядру таламуса, проецируясь (в том числе) к передней поясной коре. Эта область отвечает за аффективный компонент боли. Доказательством этого служит тот факт, что у пациентов с хроническим болевым синдромом успешно выполняют хирургическое пересечение (цингулотомию) или удаление (цингулэктомию) поясной коры. Пациенты сообщают, что сила болевых ощущений не изменилась, но боль при этом не кажется им такой нестерпимой. Точно такой же эффект дают инъекции морфия, вероятно, потому, что в передней поясной коре сосредоточено наибольшее число опиоидных рецепторов.
После цингулэктомии часто возникает отек участка мозга, осуществляющий контроль за мочевым пузырем. В связи с этим в течение какого-то времени пациентов может беспокоить недержание мочи. Однако, что важнее, более чем у половины больных после операции развивается «аффективное уплощение» — люди перестают испытывать как положительные, так и отрицательные эмоции.
Резкий удар или внезапно возникшая боль любого происхождения способна вызвать у человека чувство страха. Его появление связано с активацией спиномезенцефалических волокон, идущих к ретикулярной формации среднего мозга, а также к миндалевидному телу и ядру мозга, которое в первую очередь отвечает за чувство страха (см. основной текст). Считают, что часть волокон может идти наверх в составе дорсолатерального пути Лиссауэра или рядом с ним; наличие этих волокон может объяснить сохранение болевого синдрома у некоторых из пациентов, перенесших хордотомию.
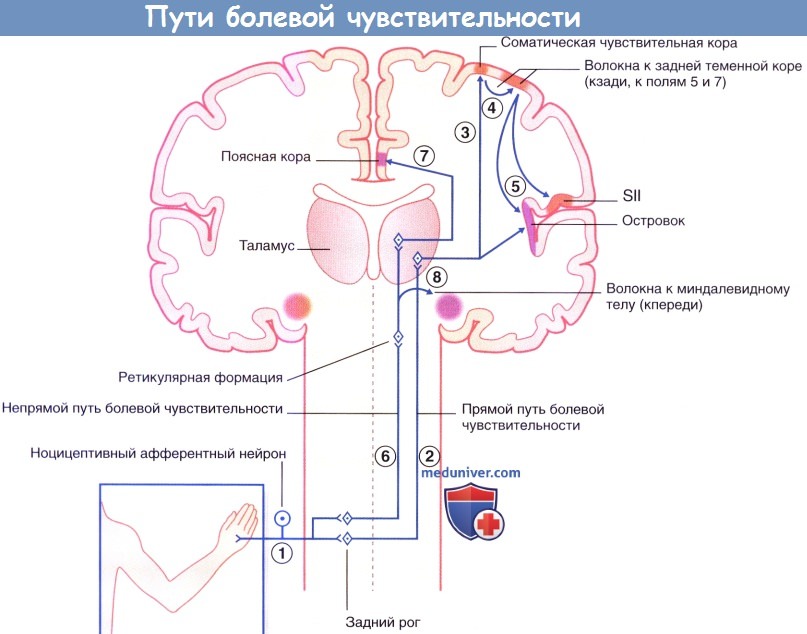
1. Периферические ноцицептивные нейроны, отдающие волокна к заднему рогу.
2. «Быстрые» центральные проецирующие боль нейроны (ЦПБН) отдают волокна непосредственно к противоположному заднебоковому таламусу и
3. Переключаются на соматическую чувствительную кору (SI). 4. Ассоциативные волокна соединяют SI с задней теменной корой, где происходит анализ тактильных ощущений («Где?» и «Как сильно»?), а также зрительное ориентирование («Откуда?»).
5. От задней теменной коры волокна идут к SII, где происходит интеграция тактильных и зрительных ощущений. Спереди происходит переключение на кору островка, куда могут также поступать импульсы от таламуса. Этот участок коры отвечает за вегетативные и эмоциональные реакции.
6. «Медленные» ЦПБН через ретикулярную формацию передают сигнал к медиальному таламусу. Волокна направляются также кпереди, в префронтальную кору (здесь не показана), где ощущения подвергаются комплексному анализу.
7. Волокна направляются вверх к поясной коре, где в норме возникает реакция эмоционального отвращения («избегание»),
8. Некоторые ЦПБН возбуждают нейроны ретикулярной формации, которые сообщаются с миндалевидным телом. Эти связи обеспечивают возникновение испуга.
е) Центральная боль. Центральная боль практически всегда возникает вследствие активации центральных проецирующих боль нейронов (ЦПБН) спиноталамического и спиноретикулярного путей. За эти процессы отвечают следующие три механизма.
• Длительная активация глутаматных NMDA-рецепторов стимулами от заднего корешка, которую наблюдают в течение нескольких недель или месяцев. В результате развивается долгосрочная потенциация ЦПБН.
• Порог возбудимости ЦПБН может еще больше снижаться путем запуска транскрипции определенных генов за счет появления дополнительных глутаматных рецепторов на их нейронах.
• Для третьего механизма лучше всего подходит определение «парадоксальный». Этот механизм уже описан в отдельной статье на сайте при обсуждении супраспинальной антиноцицептиеной системы, когда серотонинергические нейроны, проецирующиеся от большого ядра шва (БЯШ) среднего мозга, могут тормозить активность ЦПБН за счет активации энкефалинергических вставочных нейронов. Исследования на животных показали, что хотя для появления центральной боли может быть достаточно одного из первых двух механизмов, для ее поддержания необходимо, чтобы несеротонинергические нейроны БЯШ облегчили возбудимость ЦПБН. Действие этих нейронов обусловлено неизвестным возбуждающим нейромедиатором. Самый очевидный пример такой боли—фантомная боль, при которой сильные болевые ощущения возникают в дистальной части ампутированной конечности.
Один из видов центральной боли — таламическая боль, которая возникает при инсульте в области белого вещества около заднего вентрального ядра таламуса. Появление сильнейшей боли в противоположной половине тела может быть связано с нарушением нормальных тормозных влияний, которые поступают в задние отделы таламуса от близлежащих ретикулярных ядер.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
Источник

