- Механизм стресса роль гормонов
- Механизмы развития стресса, роль нервно-гормональных факторов
- Механизмы положительного и негативного действия гормонов стресса
- Роль гормонов в развитии стресса
- Изменения в органах и системах при стрессе
- Стресс-лимитирующие системы организма
- Биологическое значение стресса
- 6. Реактивность и резистентность организма
- Гормоны стресса и их влияние
- Какие бывают гормоны стресса?
- 1. Адреналин
- 2. Норадреналин
- 3. Кортизол- синоним беспокойства и тревоги!
- Пролактин
- Как снизить гормоны стресса?
Механизм стресса роль гормонов
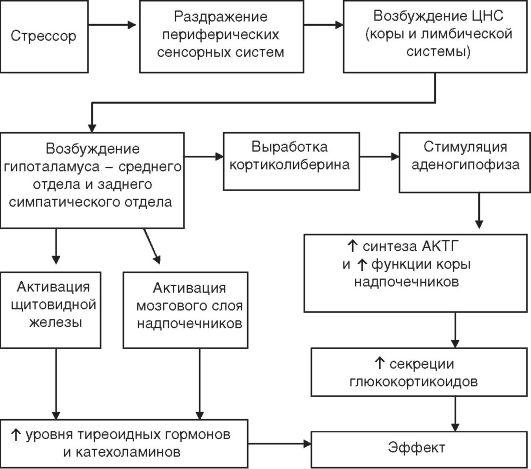
Примером неспецифического участия эндокринной системы в приспособительных реакциях организма являются изменения ее деятельности при стрессе. Состояние стресса возникает как следствие действия на организм любых сильных, в том числе экстремальных и повреждающих, раздражителей. При действии на организм экстремальных факторов неспецифические реакции стресса прежде всего направлены на стимуляцию энергетического обеспечения приспособительных процессов. Ведущую роль в этих неспецифических реакциях играют катехоламины и глюкокортикоиды, в значительных количествах мобилизуемые в кровь (рис. 6.30). Активируя катабо-лические процессы, эти гормоны ведут к гипергликемии — одной из начальных реакций субстратного энергообеспечения.
Как следствие гипергликемии на некоторое время повышается в крови уровень инсулина. Метаболические перестройки при таком гипергормональном профиле связаны, прежде всего, с активацией в печени фосфорилазы и гликогенолизом, а поступающая в кровь глюкоза под влиянием инсулина интенсивно утилизируется тканями, прежде всего скелетными мышцами, что увеличивает их работоспособность и повышает теплообразование в организме. Жиромобили-зующий эффект глюкокор-тикоидов и катехоламинов способствует повышению в крови второго важнейшего энергетического субстрата — свободных жирных кислот.
Однако подобный «форсированный» режим функционирования эндокринной системы из-за ограниченности функциональных резервов не может длиться долго, вскоре содержание инсулина в крови уменьшается, что носит название «функциональный транзиторный диабет». Это необходимое условие для усиления жиромобилизующего эффекта глюкокортикоидов и активации глюконеогенеза. Важнейшим источником глюкозы как энергетического материала в этот период становится глюко-неогенез, но на образование глюкозы расходуется дефицитный пластический материал — аминокислоты.
Необходимым условием длительно повышенного энергоснабжения является переключение энергетического обмена с углеводного типа на липидный, тем более что углеводные резервы в виде гликогена достаточно быстро оказываются практически исчерпанными. Постепенно снижается продукция глюкокортикоидов, устанавливается новое гормональное соотношение: нерезко повышенный уровень глюкокортикоидов при более значительном снижении уровня инсулина. Этот новый уровень функционирования эндокринной системы способствует восстановлению равновесия между катаболическими и анаболическими процессами, расходы белка на энергетические нужды снижаются.
Жиромобилизующий эффект гормональной перестройки и образование транспортной формы эндогенного жира — липопротеинов очень низкой плотности — приводят к тому, что растет использование клетками липидов как источников энергии. Жирные кислоты интенсивно окисляются в скелетных мышцах, миокарде и печени. Образующиеся при этом кетоновые тела усиленно окисляются в мышечной ткани, почках, а также сердце и мозге. Особенно резко ограничивается потребление углеводов мышечной и жировой тканью, что экономит глюкозу для углеводзависимых тканей — головного мозга, кроветворной ткани и эритроцитов, в некоторой степени — миокарда. Таким образом, происходящие при стрессе гормональные и метаболические перестройки обеспечивают длительное неспецифическое повышение энергообеспечения приспособительных процессов.
Стресс как неспецифическая реакция приспособления и компенсации нарушенных функций может при резкой выраженности сопровождаться и активацией гипоталамо-гипофизарно-тиреоидной системы, приводя к росту в крови уровня тиреоидных гормонов. Физиологический стресс, например эмоциональное напряжение, напротив, характеризуется снижением гормональной активности щитовидной железы. Гиперфункция щитовидной железы в ответ на повреждение тканей является неспецифической реакцией компенсации, поскольку тиреоидные гормоны, благодаря стимуляции синтеза белков, способствуют клеточным регенеративным процессам и репарации поврежденных структур. Активация гипоталамо-гипофизарно-тиреоидной системы может носить и черты специфической компенсации, например в условиях холодового стресса, как компенсация термического угнетения метаболизма.
Стресс при экстремальных состояниях сопровождается активацией и других гормональных систем — гипоталамо-гипофизарно-андрогенной и гипоталамо-нейрогипофизарной. Повышение активности системы гонадолиберины—гонадотропины—андрогены (одним из проявлений является повышение либидо) и избыточно секретируемые при этом андрогены за счет анаболического эффекта способствуют репаратив-ным процессам.
При хирургическом и эмоциональном стрессе повышается секреция вазопрессина. Компенсаторное значение активации секреции вазопрессина заключается в облегчении консолидации процессов памяти, формирования аналгезии, потенцировании эффектов кортиколиберина на секрецию кор-тикотропина, восстановлении нарушенной при кровопотере гемодинамики. Избыточная секреция вазопрессина при травмах является примером опережающей перестройки эндокринных механизмов компенсации, реализующей избыточный гормональный сигнал для предотвращения возможности потери организмом воды при кровотечении. Реакция гипоталамо-нейрогипофизарной системы может быть и специфической компенсацией возникших в организме нарушений водно-солевого и осмотического гомеостазиса (осмотический стресс).
Источник
Механизмы развития стресса, роль нервно-гормональных факторов
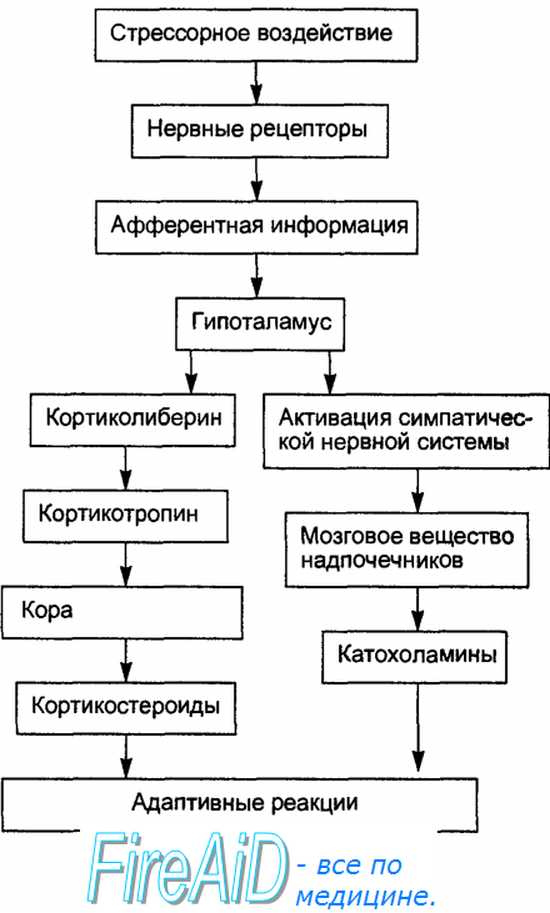
При стрессе гипоталамус может активироваться не только нервными влияниями, но и гуморальными факторами: гипоксией, гипогликемией, интерлейкинами (IL-1, IL-6), фактором некроза опухолей (TNF), интерфероном (IFN) (т.е. при инфекциях, лихорадке, сепсисе и др. может осуществляться цитокиновая регуляция стресса).
Рис. 8— Патогенез стресса
Механизмы положительного и негативного действия гормонов стресса
Уже в начальной стадии тревоги в в гипоталамусе увеличивается выработка кортиколиберина и гипоталамических нейропептидов (предшественников вазопрессина и окситоцина), обладающих следующими эффектами:
– кортиколиберин активирует центр страха и тревоги, вызывает анорексию и усиливает двигательную активность, стимулирует САС, повышает АД и увеличивает синтез АКТГ, может стимулировать лимфоцитарную продукцию эндорфинов;
– АКТГ стимулирует кору надпочечников, повышает синтез СТГ, активирует липолиз, увеличивает транспорт аминокислот в мышцы, снижает распад глюкокортикоидов в печени, в результате чего удлиняется время их циркуляции в крови. В ЦНС АКТГ влияет на поведенческие реакции: усиливает тревогу и страх, подавляет половое влечение, повышает кратковременную память.
Таким образом, кортиколиберин и АКТГ стимулируют центры страха и тревоги в лимбической системе, что создает характерный эмоциональный фон в начальной стадии стресса.
– вазопрессинзадерживает воду и сохраняет ОЦК, что важно при кровотечениях; вызывает констрикцию сосудов кожи и мышц, а в больших дозах — коронарных сосудов (в связи с чем он является фактором риска сердечно-сосудистой патологии при стрессе), усиливает распад гликогена, активирует липогенез в адипоцитах, способствуя поглощению «излишней» глюкозы и избытка жирных кислот. Стимулирует память, снижает ответ ЦНС на боль.
– окситоцин стимулирует иммунный ответ, обладает инсулиноподобным действием на жировую ткань (аналогично антидиуретическому гормону — АДГ).
– тиреоидные гормоны увеличивают основной обмен и способствуют развитию гипергликемии, повышают катаболизм белка, усиливают липолиз, что способствует кетоацидозу; увеличивают диурез, повышают возбудимость ЦНС и симпатической нервной системы, в результате чего могут отмечаться тахикардия и гипертония. Продукты распада тиреоидных гормонов обладают свойствами катехоламинов.
Метаболический эффект — изменение углеводного, белкового, липидного и других обменов с целью мобилизации энергетических ресурсов в активно работающие органы: сердце, мозг, отчасти в печень, почки:
изменения углеводного обмена — глюкокортикоиды и катехоламины снижают захват глюкозы инсулинозависимыми тканями и органами (скелетные мышцы, органы ЖКТ, жировая ткань). Одновременно повышается доступность глюкозы для сердца, мозга, почек, эритроцитов — их клетки имеют как инсулинозависимые, так и инсулинонезависимые системы захвата и метаболизма глюкозы, стимулируют глюконеогенез.
Изменения белкового обмена — глюкокортикоиды увеличивают синтез белка в сердечной мышце, печени, в органах ЦНС, но одновременно снижают синтез белка и повышают его распад в коже, костях, скелетных мышцах, в лимфоидной и жировой ткани.
Изменения жирового обмена — глюкокортикоидов активируют липолиз, освобождая из подкожной жировой клетчатки, легких и костного мозга неэтерифицированные жирные кислоты, используемые сердечной и скелетными мышцами, а также почками как энергетические субстраты.
Источник
Роль гормонов в развитии стресса
В развитие стресса вовлекается большое количество гормонов, продуцируемых различными железами, однако ведущую роль играют гормоны надпочечников, которые обеспечивают развитие адаптивных изменений.
Гормональные механизмы развития стресса схематически представлены на рис. 5, 6.
Изменения в органах и системах при стрессе
Сердечно-сосудистая система. Выделение катехоламинов, активация ренин-ангиотензин-альдостероновой системы вызывают: спазм периферических сосудов, тахикардию, увеличение ударного выброса и артериального давления, увеличение объема циркулирующей крови.
Дыхательная система. Катехоламины вызывают: расширение бронхов, уменьшение секреции слизи в дыхательных путях, увеличение секреции сурфактанта, что приводит к гипервентиляции.
Система крови. Увеличивается число нейтрофилов, снижается количество моноцитов, эозинофилов и лимфоцитов, активируется образование эритроцитов и тромбоцитов.
Иммунная система. Развивается выраженное угнетение клеточного и гуморального иммунитета, подавляется фагоцитоз, снижение синтеза антител, уменьшается продукция цитокинов. При продолжительном стрессе развивается вторичный иммунодефицит.
Стресс-лимитирующие системы организма
В настоящее время показано существование в организме специальных механизмов, ограничивающих интенсивность развития стресса, которые получили название стресс-лимитирующих. Стресс-лимитирующие системы подразделяются на 2 группы: центральные, которые оказывают свое антистрессорное действие через ЦНС, и периферические, которые обеспечивают снижение негативного воздействия избытка стрессорных гормонов на органы-мишени (рис. 7).
К центральным стресс-лимитирующим системам относятся: опиоидергическая (эндорфины, энкефалины), ГАМК-ергическая, дофаминергическая, мелатонин. Они подавляют продукцию катехоламинов и других стрессорных гормонов, стимулируют антиоксидантную систему.
К периферическим стресс-лимитирующим системам относятся: простагландины (Е и А), антиоксиданты, белки теплового шока (HSP). HSP снижают взаимодействие стероидов с их рецепторами на клетках-мишенях, предупреждают развитие мутаций, стимулируют образование антиоксидантов.
Биологическое значение стресса
Развитие стрессорной реакции способствует повышению неспецифической резистентности организма. При продолжительном или чрезвычайно сильном действии раздражителя стресс-реакция превращается в дистресс и становится механизмов повреждения в организме, что проявляется развитием так называемых болезней адаптации, к которым относят онкологические заболевания, сахарный диабет, гипертоническую болезнь, язвенную болезнь желудка и двенадцатиперстной кишки, ожирение, иммунодефициты, нервно-психические расстройства и т.д.
6. Реактивность и резистентность организма
Реактивность — свойство целостного организма определенным образом реагировать на воздействия окружающей среды. Отдельные клетки и ткани обладают возбудимостью или раздражимостью. Реактивность проявляется на уровне целого организма. Это — основное свойство организма как единой биологической системы отвечать на воздействия окружающей среды.
Реактивность выражается в изменении жизнедеятельности организма: изменениях обмена веществ, регуляторных влияний, а также в развитии защитно-приспособительных процессов. Она характеризуется тонким дифференцированием реагирования, т. е. различным уровнем по отношению к различным раздражителям. Одной из форм реактивности является резистентность — способность организма противостоять действию патогенных факторов. Оба эти свойства могут изменяться однонаправленно или иметь обратные соотношения (например, высокая реактивность к звуковым раздражениям, проявляется снижением резистентности).
В целом реактивность — приспособительное явление, но иногда утрачивает приспособительный характер (изменение иммунной реактивности может привести к аллергии и самоповреждению организма) (рис. 5).
Источник
Гормоны стресса и их влияние
Стресс – очень сложное явление, которое затрагивает все процессы, протекающие в организме. Не секрет, что по большей части он зависит от работы биологически активных веществ. Это гормоны стресса. И их много. Каждый из них незаменим и действует сродни лекарству: в маленьких дозах исцеляет, но в большом количестве превращается в замедленный яд.
Какие бывают гормоны стресса?
Стресс во всех его проявлениях регулируется определенными гормонами, которые организм вырабатывает в ответ на определенное событие. Три самых важных из них:
- адреналин; норадреналин; кортизол.
1. Адреналин
С функциями адреналина знакомы многие. Когда выделяется адреналин, повышается давление, увеличивается частота нервных сокращений, возбуждается нервная система. Человек начинает беспорядочно двигаться, становится крайне эмоциональным. Этот гормон активизируется во время экстремальных видов спорта и при сильном стрессе. Хронический стресс провоцирует постоянную выработку адреналина, что негативно влияет на работу сердца и ЖКТ.
2. Норадреналин
Норадреналин легко спутать с адреналином, но они имеют разные назначения. Норадреналин позитивно влияет на работу мозга при кратковременном стрессе, активизируя отделы памяти. Благодаря этому гормону, кратковременный стресс становится полезным, т. к. мы лучше учимся и запоминаем информацию. Норадреналин отвечает за положительные эмоции во время стресса (победа в игре, казино). Избыточное выделение норадреналина вкупе с индивидуальными чертами личности вызывают зависимость.
3. Кортизол- синоним беспокойства и тревоги!
Кортизол – гормон, выделяемый при сильном стрессе. Он приводит организм в состояние боевой готовности, чтоб мы могли быстро среагировать на опасность. Увеличивает уровень сахара в крови, повышает доступность восстановительных веществ. В нормальных условиях гормон быстро выводится из организма.
Хронический стресс стимулирует выделение огромного количества кортизола, что приводит к таким последствиям как:
- сонливость; тяга к сладкой и вредной пище; ухудшение памяти, внимания; депрессия; снижение иммунитета.
Пролактин
Также существует гормон стресса, который превалирует в основном у женщин – это пролактин.
Пролактин – гормон стресса, который иногда называют «женский гормон». Вырабатывается в передней доле гипофиза. Отвечает за репродуктивную функцию, лактацию. Пролактин также контролирует регулярность менструального цикла. Физический или психологический стресс способствует увеличению уровня пролактина в крови, что приводит к таким последствиям:
- задержки менструального цикла, аменорея; возникновение лактации, не связанной с родами;
Как снизить гормоны стресса?
Первое, что надо сделать при стрессе – нормализовать свои биологические часы и постараться убрать этот самый стресс из своей жизни. Наладить режим дня, принимать пищу согласно потребностям, высыпаться. Для борьбы со стрессом важен качественный сон не менее восьми часов в сутки.
Источник