Что такое метаболизм: почему он бывает быстрым и медленным
Метаболизм — слово, которое на слуху у каждого, кто худеет. Считается, что его нужно «разогнать» на полную мощность, и тогда вы сможете обмануть организм и сжигать больше калорий за то же время. Почти как секретная кнопка, на которую нужно нажать. Поэтому так привлекательны разгоняющие метаболизм продукты питания, диеты и тренировки. Читайте в этой статье про то, что такое метаболизм вообще и почему он бывает быстрым и медленным.
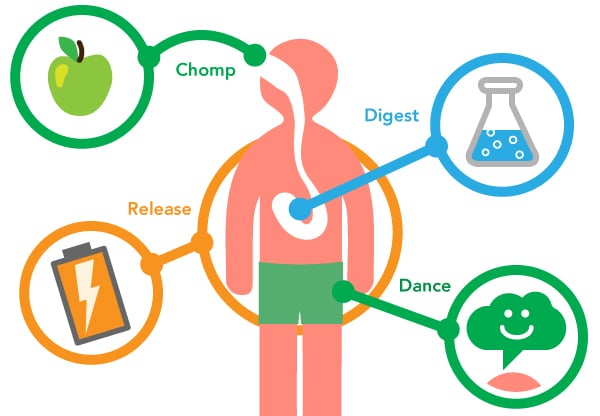
Что такое метаболизм?
Эволюционно организм человека стремится поддерживать идеальный с точки зрения выживания вес и процент жира, которые задает генетика. Это защищает человека от любых крайностей: как от истощения, так и от ожирения. И то, и другое снижает шансы передать свои гены потомству в дикой природе.
«Идеальным» для выживания весом управляет отдел мозга — гипоталамус. Именно он замедляет или ускоряет обмен веществ, если видит какие-то отклонения от нормы для конкретного человека. С помощью самых разных веществ — гормонов, уровня глюкозы и аминокислот в крови и многого другого — он собирает информацию о том, что происходит в организме: достаточно ли жира запасено, регулярно ли поступает еда, насколько она калорийная.
Сравнивая данные с «идеальной» генетической установкой, гипоталамус подкручивает метаболизм то вверх, то вниз, в зависимости от ситуации. Посмотрим на примерах, как выглядит идеальный метаболизм.
Если человек ел непривычно много для себя в течение одного или нескольких дней, его аппетит сам по себе снижается в последующие дни. Человек будет есть меньше, сам того не замечая. Заодно он будет более подвижным и активным. И даже если он все же наберет лишний вес за отпуск или праздники, он быстро от него избавится, как только вернется к обычной жизни, ничего специального для похудения не делая. Гипоталамус отрегулирует аппетит и уровень активности так, чтобы вернуть систему в равновесие.
И обратная ситуация. Тот же человек вдруг стал есть непривычно мало для себя: сел на диету, перестал есть из-за стресса, занятости. В ответ на это гипоталамус в следующие дни увеличивает аппетит, чтобы наверстать среднюю калорийность. Заодно он снижает активность — человек становится более вялым, сонным, двигается меньше и при первой возможности хочет посидеть или полежать.
Выходит, что человек со здоровым обменом веществ может иметь примерно один и тот же вес долгие годы, ничего специального не делая.
Как гипоталамус делает это?
Аппетитом мозг управляет с помощью самых разных механизмов.
- Снижают аппетит лептин, глюкагон, обестатин, нейропептиды S и FF, холецистокинин, нейротензин, энтеростатин, тиреолиберин и другие гормоны.
- Аминокислоты и глюкоза в крови — это признак того, что человек поел.
- Заполненный желудок: в нем есть датчики на механическое растяжение. Они сообщают гипоталамусу о еде внутри.
- Сокращение желчного пузыря и выработка им желчи после еды.
- Наполнение кишечника.
Усиливают голод и толкают человека на поиски еды и тягу к определенным продуктам, особенно калорийным, следующие химические вещества: грелин, нейропептид Y, орексин, галанин, ноницептин, мотилин, В-эндорфины и др. А так же низкий уровень глюкозы и аминокислот, пустой желудок.
Человек начинает получать большее наслаждение от еды — от ее вкуса, запаха. Еда становится источником удовольствия. За это отвечают дофамин и эндорфины, которые выбрасываются каждый раз, когда человек поел.
Это отличный механизм защиты от голодания и истощения: если бы мы были равнодушны к еде и не замотивированы ее искать, не могли бы получать от нее почти наркотическое удовольствие, дела с выживанием были бы плохи. Хотя, сегодня это играет против нас: еду больше не нужно искать. Самая вкусная, жирная и сладкая еда — в избытке на расстоянии вытянутой руки. Из-за этого дофаминовые и эндорфиновые рецепторы бомбардируются чаще, сильнее и больше, чем заложено природой. Это сбивает все внутренние настройки организма в плане пищевого поведения.
Быстрый и медленный метаболизм
Описанная выше ситуация с обменом веществ — идеальная. В жизни же иногда все как-будто наоборот: чем больше человек ест и меньше двигается, тем меньше хочется двигаться и больше есть. А кто-то — худой, очень мало ест и больше есть не может.
Чтобы понять про быстрый и медленный обмен веществ, нужно знать вот что. Нервная система человека состоит из двух отделов. Первый — центральная нервная система. Она состоит из головного и спинного мозга. Второй — вегетативная нервная система. Это главный регулятор метаболизма. Она контролирует работу желез, органов, пищеварение, управляет питательными веществами, поступившими с едой, и делает другие важные для жизни вещи.
Вегетативная нервная система имеет две ветви: симпатическую и парасимпатическую.
- Симпатическая нервная система в жизни включается во время психического или физического стресса, а в дикой природе — во время бегства, защиты или нападения. Она «ускоряет» метаболизм, отвечает за мобилизацию энергии из запасников и ее использование. Она контролирует работу мышц, сердца, щитовидной железы, половой системы, стимулирует высвобождение адреналина.
- Парасимпатическая нервная система восстанавливает организм после стресса. Она «замедляет» метаболизм, стимулирует пищеварение, ускоряет усвоение питательных веществ и их запасание. Она управляет так же иммунной системой.
В зависимости от ситуации — стресс или восстановление — у любого человека включается либо та, либо другая ветвь. Но у некоторых людей каждая из них может доминировать большую часть времени. Это и определяет скорость метаболизма.
Важно понимать: говоря про быстрый и медленный метаболизм, мы не говорим о заболеваниях обмена веществ, которые нужно лечить у врача. Все остальное — пределы нормы здорового человека, но с отклонениями в одну или другую сторону.
Быстрый обмен веществ
Люди с доминирующей симпатической нервной системой, — счастливчики для тех, кто всю жизнь пытается худеть. Они стройные и не имеют проблем с лишним весом.
Это обычно живые, активные, эмоциональные люди, с быстрыми, резкими движениями. Пульс их более частый, а давление — повышенное. У них более активно работает щитовидная желез. Они всегда немного нервные, возбужденные по жизни и тратят много энергии в течение дня. Они не толстеют, но и с трудом набирают мышцы.
Медленный обмен веществ
Люди с доминирующей парасимпатической нервной системой набирают вес легко, а худеют — с трудом. Это малоподвижные, спокойные, расслабленные, а в крайних проявлениях — апатичные, вялые люди. Они быстро усваивают питательные вещества, что на фоне очень хорошего аппетита создает проблемы с лишним весом.
В ответ на лишнюю еду гипоталамус может не снижать аппетит в следующие дни, как могло быть в идеальной ситуации. Одна из проблем обмена веществ — плохая чувствительность мозга к лептину.
Лептин — гормон, который вырабатывает жировая ткань. С его помощью гипоталамус видит количество запасенной энергии (жира) в организме. Много жира = много лептина. Гипоталамус снижает аппетит и повышает активность, ведь бояться голодной смерти не нужно. Мало жира = мало лептина, значит энергии мало, аппетит нужно увеличить, а желание двигаться — снизить.
Но иногда гипоталамус не видит лептин, даже если и его, и жира много. А это означает постоянный голод и снижение активности. Человек начинает есть со временем все больше и больше.
Иногда плохая чувствительность к лептину — приобретенная, из-за плохого образа жизни и лишнего веса. А иногда — генетическая, когда мутация в самой структуре гормона или в рецепторах гипоталамуса мешает правильно принимать сигнал.
Если человек с медленным обменом веществ решит вдруг сесть на голодную диету, его ждут большие мучения: аппетит становится просто зверским. Начинает тянуть на все самое жирное, сладкое или соленое. Активность падает очень сильно и переводит его в режим амебы с постоянными мыслями о еде, плохим настроением, отсутствием сил и либидо. Работа щитовидной железы еще больше ухудшается.
К этому добавляется низкая чувствительность мышечных клеток к инсулину, что делает отложение жира более легким.
С эволюционной точки зрения выживали именно те, кто мог запасать больше жира, чтобы пережить голод, долгие зимы и передать свои гены потомству. Теперь это уже больше не эволюционное преимущество, но многие из нас носят эти гены и всю жизнь борются с лишним весом.
Изменение скорости метаболизма
До этого речь шла о вещах отчасти генетических. Но человек — система не замкнутая. На нас очень влияет окружающая среда. Еще сто лет назад метаболизм был менее зависим от нее. Но сегодня у нас изобилие еды — жирной, сладкой, калорийной, всегда доступной. Мы двигаемся меньше — у нас есть машины, метро, самолеты, а всякая техника упрощает жизнь.
Малоподвижный образ жизни, плохое питание, стрессы, недостаток сна – все это сбивает систему саморегуляции веса, нарушает пищевое поведение. Гипоталамус перестает правильно воспринимать сигналы организма, мышцы теряют чувствительность к инсулину. В худшем сценарии развивается метаболический синдром — диабет 2 типа, гипертония и атеросклероз, которые часто идут вместе и усиливают друг друга.
И если с генетикой бороться трудно, с образом жизни можно сделать многое. Даже самый безнадежный с точки зрения генетики человек способен на большие перемены.
«Разгон» метаболизма
Говорить о «разгоне» метаболизма не правильно. Вместо этого нужно думать о том, как вернуть его в норму. Сильно ускоренный метаболизм — это серьезное заболевание (например, Базедова болезнь).
Что снижает метаболизм? Малоподвижный образ жизни, отсутствие силовых тренировок, мышц, увлечение сахаром и насыщенными жирами, нарушение пищевого поведения. И «лечится» это изменением образа жизни.
Вы похудеете, восстановите чувствительность клеток к инсулину с помощью диеты и силовых тренировок, и обмен веществ придет в норму, насколько это возможно. Вы научитесь есть, когда голодны и не есть, когда сыты, перестанете бомбардировать мозг эндорфинами от калорийной еды, улучшите чувствительность к лептину.
А совсем не наоборот: сначала «разогнать» обмен веществ, а потом похудеть на этих скоростях. Совершенно бессмысленно ускорять метаболизм, чтобы худеть. Он возвращается к своему нормальному состоянию в процессе похудения.
Источник
Механизм обеспечивающий ускорение обмена веществ при стрессе
Сотрудники «Научно-исследовательского клинического института педиатрии им. цакадемика Ю.Е. Вельтищева», РНИМУ им. Н.И. Пирогова Минздрава России и «Курчатовского института» города Москвы, подготовили обзорную статью на тему молекулярного стресса.
Стрессы возникают в ответ на различные внешние и внутренние воздействия на организм. Из них наиболее часто в литературе обсуждаются окислительный, нитрозативный и карбонильный стрессы, характеризующиеся накоплением в клетках и внеклеточной жидкости свободных радикалов и других активных форм кислорода, а также активных карбонильных соединений. Эти активные (сигнальные) молекулы являются мощными неспецифическими модификаторами структуры и функции белков, липидов, углеводов, вмешиваются в биоэнергетику. Активные сигнальные молекулы в небольших дозах необходимы для адаптивных реакций организма, вызывают торможение нарушений метаболизма, особенно белков, однако при избыточном накоплении приводят к патологическим процессам с выраженной модификацией белков с развитием сердечно-сосудистых, нейродегенеративных, аутоиммунных, соединительнотканных болезней и рака. Обсуждаются возможные меры защиты и профилактики от метаболических стрессов.
По определению Г. Селье, стресс есть неспецифический ответ организма на любое предъявляемое воздействие, вызывающее неспецифическую потребность осуществлять приспособительные функции («бороться или бежать»). При стрессе, наряду с адаптацией к сильным раздражителям, имеются элементы не только активации (напряжения) различных функций, но и повреждения структуры и функций как регуляторных систем, тканей и органов, так и клеток и их молекулярных компонентов. Увеличивается объем коркового вещества надпочечников, уменьшаются вилочковая железа, селезенка и лимфатические узлы, нарушается обмен веществ, а также изменяется состав крови: отмечаются лейкоцитоз, лимфопения, эозинопения, меняется структура и функции гемоглобина, альбумина, повышается содержание продуктов стрессового катаболизма белков (средние молекулы) и т.д.
Стресс на уровне организма быстро (секунды) переходит в «метаболический, молекулярный», при котором образуются высокореакционноспособные сигнальные агенты, в малых дозах вызывающие защитные реакции и становящиеся токсичными в больших дозах. В результате значительного усиления
окислительных процессов (окислительный стресс) в крови накапливаются сигнальные, биологически активные низкомолекулярные соединения, обусловливающие модификацию липидов, углеводов, белков, рецепторов, гормонов, митохондрий, нуклеиновых кислот и даже генома.
Окислительный стресс. Это понятие используется для обозначения ситуации, в которой увеличивается продукция свободных радикалов и других активных форм кислорода с нарушением баланса прооксиданты/антиоксиданты в пользу первых с выраженным увеличением продукции активных форм кислорода и снижением антиоксидантных функций. Активные формы кислорода образуются в результате неблагоприятных (стрессорных) ситуаций: попадание в организм чужеродных ксенобиотиков, действие ультрафиолетовой или ионизирующей радиации, влияние стрессорной активации окислительных ферментов (ксантиноксидаза, НАДН-оксидаза, пероксисомальные оксидазы, цитохром Р450) и др. Образующиеся как продукт аэробного метаболизма в норме в небольших количествах активные формы кислорода необходимы для различных физиологических процессов в клетке. Напротив, их избыточная продукция оказывает вредное действие на здоровье, повреждая структуру и функции клеток, особенно при дефиците антиоксидантов. Степень повреждающего действия зависит от типа оксиданта, объема и интенсивности продукции свободных радикалов, качества и активности антиоксидантов и способности других систем адаптации к стрессу.
Cреди метаболических заболеваний, сочетающихся с окислительным стрессом, наибольшее внимание привлечено к сердечно-сосудистым болезням (атеросклероз, ишемическая болезнь сердца, артериальная гипертония), болезням центральной нервной системы (болезнь Паркинсона, Альцгеймера), почек, дисфункции эндокринных органов, аутоиммунным, хроническим воспалительным болезням, различным опухолям.
Карбонильный стресс. Образование активных форм кислорода и азота происходит в основном
в митохондриях, где эти формы оказывают ингибирующее действие на дыхательные ферменты, нарушая движение электронов по электронно-транспортной цепи митохондрий с дополнительным образованием супероксида и снижением синтеза АТФ. В связи с этим включается более древний способ образования АТФ через гликолиз как в анаэробных, так и аэробных условиях. В результате активации гликолиза и пероксидации мембранных липидов повышается синтез еще ряда активных модификаторов белков – активных карбонильных соединений, обусловливающих развитие карбонильного стресса: производных глюкозы (глиоксаль, метилглиоксаль, 4-гидроксиноненаль, активные карбонильные формы глюкозы, почти не встречающиеся в норме и содержание которых значительно повышается при гиперглюкозурии) и производных полиненасыщенных жирных кислот (альдегиды, кетоны, кетоальдегиды, кетокислоты, формальдегид, малоновый диальдегид). Активные карбонильные соединения способны карбонилировать (гликировать) белковые молекулы.
Карбонильный, окислительный и нитрозативный стрессы в биологических системах неразделимы и образуют «порочный круг», вместе составляют элементы сложной сети реакций. Эти молекулярные стрессы с образованием сигнальных молекул необходимы для быстрых неспецифических реакций организма («бороться или бежать»), индуцируя неспецифические посттрансляционные модификации, обусловливающие механизм быстрого приобретения новых свойств. Активные стрессорные сигнальные молекулы осуществляют неферментативную модификацию белков, липидов, нуклеиновых кислот, в том числе неферментативное гликирование. Защитное действие активных сигнальных молекул проявляется напрямую и опосредованно. Прямая защита заключается в стабилизации (выключении функции) белков клетки. Опосредованная защита включает участие сигнальных молекул в следующих процессах: 1) регуляция сигнальных путей клетки, в том числе ответственных за реакцию на стресс; 2) перепрограммирование эпигенома (через гистоны, ДНК метилазы); 3) появление дополнительных реакций метаболизма; 4) запуск механизма мутагенеза, индуцированного стрессом. Защитой от карбонильного стресса служат активация глиоксилазы I и II, кеторедуктазы, утилизация активных форм кислорода в организме, восстановленный глутатион, а также использование фармпоглотителей метилглиоксаля (метформин, карнозин).
Модифицированные белки. Целый ряд изменений, возникающих при стрессе, имеет биохимическую целесообразность, т.е их до определенной степени выраженности можно считать адаптационными. Для каждого вида метаболического стресса имеются дозозависимые границы физиологического и патологического воздействия. Благодаря гормональной стимуляции (гормезису), малые дозы активных молекул, как и мягкие экологические стрессоры, не только не причиняют вред организму, но даже способствуют формированию устойчивого феномена, приспособлению к широкому разнообразию изменений внешней и внутренней среды.
В результате воздействия активных молекул в организме накапливаются модифицированные альбумин, гемоглобин, липопротеины низкой плотности (ЛПНП), коллаген. Модифицированные белки со слегка измененной структурой при адекватном воздействии сигнальных молекул обратимо приобретают новые каталитические и агрегационные свойства, а также повышенную устойчивость к протеолизу, изменение коллоидных реакций, усиление агрегации и уменьшение степени дисперсности. В то же время при метаболических стрессах активные сигнальные молекулы, образующиеся уже на начальных стадиях, могут быть факторами стабилизации белковых молекул. Модификация белков и нуклеотидов может благоприятствовать развитию защитных реакций на уровне организма, а именно – провоцировать воспалительную реакцию, запустить программированную гибель поврежденных клеток (некроз, апоптоз, аутофагия), а также при повторных повреждениях индуцировать перестройки в эпигеноме.
Гликированный гемоглобин. Участие гликированного гемоглобина в развитии последствий карбонильного стресса заключается, в частности, в повреждении эритроцитов. Структурные перестройки гемоглобина происходят в результате окисления аминокислотных остатков (цистина, гистидина, тирозина, триптофана), нитрозилирования аминокислотных остатков (цистина, тирозина, триптофана, метионина), хлорирования остатков лизина, метионина, глицина, аргинина, образования стабильных соединений аминокислот с активными карбонильными соединениями. Благодаря тому, что гемоглобин относится к долгоживущим белкам (120±20 дней), аккумулирующим различные посттрансляционные модификации, его измененные формы используют в диагностике различных метаболических нарушений, например уровень гликированного гемоглобина (НbА) – более устойчивый показатель гипергликемии, который служит «золотым стандартом» при диагностике сахарного диабета. Структурные изменения гемоглобина сопровождаются его дестабилизацией, утратой ряда свойств. Гликированный гемоглобин имеет более высокое сродство к кислороду, в результате чего затрудняется отдача кислорода в тканях (тканевая гипоксия) с усилением анаэробного гликолиза.
«Неэффективный» альбумин. Влияние стрессовых ситуаций на белки демонстрируют также структурно-функциональные изменения альбумина при патологии. Альбумин – глобулярный полифункциональный транспортный белок, главным образом переносящий в клетки субстрат для образования АТФ в митохондриях – неэстерифицированные жирные кислоты (С16:0, С18:0, а также в небольших количествах С18:1 и С18:2), для которых в молекуле альбумина имеются специфические и неспецифические центры связывания; в результате заполнения этих центров обеспечивается стабильность молекулы. Нарушение таких связей приводит к катаболизму альбумина. Альбумин переносит 90% жирных кислот крови, в то время как липопротеины – только остальное количество. Кроме того, альбумин обратимо связывает и транспортирует такие низкомолекулярные эндогенные и экзогенные молекулы (лиганды), как билирубин, глюкоза, лекарственные препараты, гормоны, ионы металлов (Fe, Zn, Cu, Ni, Ca) и др., до 10 лигандов на 1 молекулу. Нарушение дисульфидных связей, в норме сохраняющих глобулярную структуру альбумина, приводит к разрыву этих связей активными сигнальными молекулами при стрессе и, как следствие, потере глобулярной структуры. Снижается количество специфических мест связывания («эффективной концентрации альбумина»), повышается индекс токсичности, зависящий от соотношения общего и «эффективного» количества альбумина, нарушается доставка необходимых субстанций к тканям. Снижение транспортных функций альбумина выявлено при атеросклерозе, ожогах, перитоните, сепсисе, гепатитах, инфаркте миокарда, лейкозе, бронхиальной астме, психических заболеваниях, уремии.
Белки и микроэлементы. При конформационной перестройке основной мишенью активных сигнальных молекул (и других эндогенных метаболитов) в белках служат SН-группы – регуляторные центры, молекулярные переключатели активности белков. SH-группы имеют повышенную способность связываться с микроэлементами, вызывая изменение свойств белков. Активные молекулы, таким образом, являются модуляторами чувствительности и резистентности клетки, могут оказывать как стимулирующее, так и угнетающее действие на метаболизм, одновременно повышая устойчивость к протеолизу, изменяя коллоидные реакции, агрегацию белков и уменьшая степень их дисперсности. Часть белков с измененной структурой объединяется в кластеры, увеличивая вязкость внутриклеточной среды. Однако часть «расплавленных белковых глобул» подвергается стабилизации и возвращается к первоначальному объему в связи с активным захватом микроэлементов, обеспечивающим плотную упаковку, возвращающим компакт- ность, но не функциональную активность, обусловливая появление чужеродных (антигенных) свойств молекуле белка.
Заключение
Неспецифический ответ организма на любое предъявленное ему требование обычно сопровождается увеличением в крови содержания стрессорных гормонов – кортизола, адреналина, мобилизующих обменные процессы. При этом организм, несмотря на изменение своего состояния, приобретает способность сохранять относительную стабильность внутренней среды. Однако при сильных раздражителях, наряду с элементами адаптации, возникают элементы напряжения и даже повреждения. Ответ на разные стимулы может развиваться как на уровне целого организма, так и в различных его системах. Молекулярные механизмы на клеточном уровне затрагивают изменения мембранных липидов, углеводов и формирование адаптивного ответа через модификацию белков, их функций и сеть ферментативных и неферментативных процессов. Под действием активированных гормонами окислительных ферментов (ксантиноксидаза, моноаминооксидаза и др.) происходит накопление в организме супероксидного аниона и его производных – активных форм кислорода с развитием окислительного стресса. Активные формы кислорода – мощный модификатор структуры и функции белков, липидов, углеводов. Кроме того, супероксид, взаимодействуя с оксидом азота, образует активные формы азота – нитриты, нитраты, пероксинитриты, обусловливая развитие нитрозативного стресса. При взаимодействии с углеводами и липидами развивается карбонильный стресс с образованием активных карбонильных соединений, также играющих роль модификаторов белковых молекул. Такая модификация обусловлена свойством активных молекул спонтанно вступать в реакции с аминокислотными остатками белков. Реакционноспособные (сигнальные) молекулы оказывают дозозависимые влияния на метаболизм – от регуляторных до нарушающих структуру биологических систем. Активные молекулы сигнализируют клетке о наличии стрессовой ситуации, участвуют в организации защитной реакции или приводят к развитию хронических обменных заболеваний, для каждого из которых отмечается преимущественное повреждение «своих» белков. Неослабевающий интерес исследователей к проблеме метаболических стрессов объясняется не только новыми открытиями в проблеме, но и поиском эффективных средств защиты от патологического действия метаболических стрессов.
Юрьева Э.А., Новикова Н.Н., Длин В.В., Воздвиженская Е.С.
Российский вестник перинатологии и педиатрии, 2020; 65:(5)
Источник