Креатинин при стрессе может повышаться
Существует множество лабораторных методов исследования работы нашего организма. Один из них — биохимический анализ крови, показывающий количество различных биологических веществ в плазме. Для простого обывателя ничего не говорит большое количество непонятных названий и цифр. В данной статье мы рассмотрим изменения такого показателя биохимического анализа крови, как креатинин.
Данное вещество является одним из конечных звеньев процесса распада белков. В печени синтезируется его предшественник — креатин, который затем с током крови поступает в мышцы. Там к нему присоединяется остаток фосфорной кислоты — образуется креатининфосфат. Данное соединение обладает большой энергией, которую оно отдает при мышечном сокращении. В этом процессе фосфатная группа отщепляется, а креатинин поступает в кровь и выводится почками. В свете всего вышесказанного становится понятно, что уровень креатинина в крови зависит от того, как много его выделяется и от того, как быстро он выводится почками. Наиболее часто уровень креатинина измеряют для оценки функционального состояния почек. Также уровень этого соединения зависит от количества мышечной массы, поэтому данные у мужчин и женщин различаются. Нормальный уровень креатинина таков:
— у мужчин — 56-115 микромоль на литр;
— у женщин — 52-96 микромоль на литр.
У детей выделительная система имеет свои особенности, кроме того, мышц у них немного, поэтому цифры будут другими:
— у детей до года — 18-36 микромоль на литр;
— у детей до четырнадцати лет — 25-63 микромоль на литр.

Как уже было сказано, по повышению или понижению концентрации креатинина в крови можно судить о состоянии организма. Все причины, которые вызывают повышение уровня креатинина можно разделить на две группы — связанные с его повышенным образованием и связанные с нарушением выделения креатинина. К первой группе относятся повышенное содержание мясных продуктов в рационе, некоторые эндокринные заболевания (гипертиреоз, акромегалия), массивное повреждение мышечной ткани в результате травмы или оперативного вмешательства. Также уровень креатинина повышается в острую фазу лучевой болезни, обезвоживании и краш-синдроме (синдроме длительного раздавливания). Как видим, все эти причины так или иначе связаны с повышенным распадом белков в организме, даже особый рацион питания может повлиять на результаты лабораторного теста.
Ко второй группе причин относят нарушение выведения креатинина в результате поражения почек. Это может наблюдаться при таких состояниях, как острая почечная недостаточность (в результате острого гломерулонефрита, закупорке мочевыводящих путей, токсического поражения почек, травме обеих почек), хроническая почечная недостаточность (при хронических инфекциях, интоксикациях, гипертонической болезни, амилоидозе почек). Также выделение креатинина затруднено при приеме некоторых лекарственных препаратов, обладающих негативным влиянием на систему почек (антибиотики, сульфаниламидные препараты).
Однако возникает вопрос — если по изменениям концентрации креатинина судят о работе почек, то как отличить повышение уровня при мясной диете, например, от патологии, связанной с нарушением выделения? Все дело в том, что креатинин не единственный индикатор работы почек в биохимическом анализе крови. При нарушениях процессов выделения изменяется концентрация в плазме крови и других веществ, например, мочевины. Все это позволяет дифференцировать поражение почек от других причин повышения уровня креатинина.
В некоторых случаях уровень креатинина может снижать ниже допустимых цифр. Это может происходит при рационе питания, бедном белками (при вегетерианской диете), снижении мышечной массы тела (дистрофические изменения, анорексия), приеме некоторых лекарств (кортикостероидных гормонов, например). Значительное уменьшение концентрации креатинина в крови происходит на последнем триместре беременности — это связано с задержкой жидкости в организме женщины.
Изменение уровня креатинина в анализе крови служит направлением на более детальное обследование организма. Это может служить первым симптомом какого-либо заболевания почек.
Учебное видео расшифровки биохимического анализа крови
— Вернуться в оглавление раздела «Физиология человека.»
Автор: Искандер Милевски. Дата обновления публикации: 19.07.2021
Источник
Креатинин в сыворотке (с определением СКФ)
Креатинин – это продукт неферментативного распада креатина и креатина фосфата, образующийся в мышцах. Он выводится из организма почками.
1-метилгликоциамидин, продукт превращения креатинфосфата, креатинин в крови.
Синонимы английские
Creatinine, Creat, Serum Creat, Cre, Blood creatinine, Serum creatinine, Urine creatinine.
Кинетический метод (метод Яффе).
Мкмоль/л (микромоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов перед исследованием.
- За 30 минут до исследования исключить физическое и эмоциональное перенапряжение.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Креатинин – это остаточный продукт, получаемый в мышцах при разрушении вещества под названием креатин. Креатин входит в цикл, обеспечивающий организм энергией для сокращения мышц. После 7 секунд интенсивной физической активности креатинфосфат превращается в креатин, затем переходящий в креатинин, фильтрующийся в почках и выделяющийся с мочой. Креатин и креатинин стабильно продуцируются нашим телом в постоянном количестве. Почти весь креатинин выделяется почками, поэтому его концентрация в крови является хорошим показателем их функции. Количество продуцируемого креатинина зависит от общей массы тела и, в частности, мышечной массы. Поэтому, например, уровни креатинина у мужчин будут значительно выше, чем у женщин и детей.
Его незначительная часть (15 %) секретируется канальцами, но в основном он производится благодаря фильтрации в клубочках. Уровень креатинина в крови не выходит за рамки нормы до тех пор, пока клубочковая фильтрация не снизится до критических значений, в особенности у пациентов с низкой мышечной массой. Затем уровень креатинина повышается.
Именно из-за большого количества составляющих (мышечная масса, пол, возраст), влияющих на концентрацию креатинина в крови, это исследование не самый лучший скрининг-тест для выявления почечной недостаточности. В то же время креатинин является более чувствительным индикатором заболеваний почек, чем мочевина.
Для чего используется исследование?
- Для оценки функции почек.
- Для оценки функции основных органов и систем (в комплексе с другими исследованиями).
- Для оценки нарушения функции почек и эффективности его лечения, если креатинин или мочевина выходят за пределы нормы и у пациента есть какое-то основное хроническое заболевание, например диабет, течение которого влияет на состояние почек.
- Если известен уровень креатинина в крови и в моче, можно подсчитать клиренс креатинина (проба Реберга) – этот тест показывает, насколько эффективно почки фильтруют из крови маленькие молекулы, такие как креатинин.
- Для подсчета скорости клубочковой фильтрации, чтобы подтвердить повреждения почек.
Когда назначается исследование?
- Через определенные промежутки времени при уже известном заболевании почек или заболевании, способном вызвать ухудшение функции почек (совместно с тестом на мочевину и на микроальбуминурию).
- При диагностике заболеваний скелетных мышц.
- Перед проведением процедуры гемодиализа и после нее.
- При симптомах дисфункции почек:
- слабость, утомляемость, снижение внимания, плохой аппетит, проблемы со сном,
- отеки на лице, запястьях, лодыжках, асцит,
- пенистая, красного или кофейного цвета моча,
- снижение диуреза,
- проблемы с актом мочеиспускания: жжение, прерывистость, изменение частоты (преобладание ночного диуреза),
- боль в поясничной области (особенно по бокам от позвоночника), под ребрами,
- высокое давление.
- При любых патологических состояниях, сопровождающихся дегидратацией.
- При подготовке к компьютерной томографии.
- Перед назначением лекарственных средств, способных вызывать повреждение почечной ткани.
Источник
Креатинин при стрессе может повышаться
Креатинин и креатинфосфат являются основными субстратами накопления и переноса энергии. Креатинин синтезируется преимущественно в печени и поджелудочной железы в рамках двух-ступенчатого механизма из глицина, аргинина и метионина и в итоге путем неферментной циклизации превращается в креатинин.
В организме человека запас креатина поддерживается за счет биосинтеза и поступления с пищей по 1-2 г в сутки. Креатин переносится кровью, а на уровне клеток — креатинин-транспортирующей системой.
В течение последних нескольких лет у человека были идентифицированы врожденные нарушения метаболизма всех трех белковых компонентов.
а) Дефицит гуанидиноацетат-метилтрансферазы (GAMT). Первый пациент с таким заболеванием был зарегистрирован Stockier et al. (1994). Ребенок родился здоровым, но в дальнейшем у него развился гипотонус, экстрапирамидные дистонические симптомы и тяжелая задержка психомоторного развития. На МРТ, выполненной в возрасте 12 месяцев, выявлен аномальный сигнал от бледного шара.
При протонной МР спектроскопии выявлено отсутствие сигналов креатина и креатинфосфата в головном мозге, что предполагает врожденное нарушение синтеза креатина. Дефицит активности GAMT выявлен в ткани печени. В ряде случаев дефицит GAMT может быть выявлен при протонной МР спектроскопии как отсутствие сигнала креатинина/фосфокреатинина в головном мозге (von Figura et al., 2000). Поддерживающее применение креатинин-моногирата (4 г в сутки) приводит к заметному улучшению и нормализации аномалий скорлупы, выявляемых при МР-спекртроскопии.
Тем не менее, концентрация креатина/креатинфосфата в головном мозге, оцениваемая при МР-спектроскопии, не достигает нормальных значений. В возрасте 15 лет пациент был способен самостоятельно ходить, но у него отмечалась тяжелая задержка умственного развития с аутистическим самодеструктивным поведением.
Дефицит GAMT наследуется аутосомным путем, ген расположен на хромосоме 19р.13.3. Выявлено несколько мутантных аллелей дефицита GAMT. Клинические проявления заболевания различны и включают мышечную гипотонию, дистонию, тяжелую эпилепсию и задержку умственного развития.
Диагностику дефицита креатина следует проводить у пациентов с гипотоническими-дистоническими симптомами в сочетании с аномалиями на МРТ или без них. Патогномоничные лабораторные изменения при дефиците GAMT включают снижение концентрации креатина и уровня креатинина в крови, спинномозговой жидкости и моче, в то время как уровень гуанидинацетата (предшественника креатина) в крови, моче и спинномозговой жидкости повышен.
Отсутствие сигнала креатина/креатинфосфата по результатам МР-спектроскопии головного мозга достаточно для постановки диагноза. Дальнейшие биохимические и генетические исследования позволяют идентифицировать лежащее в основе нарушение.
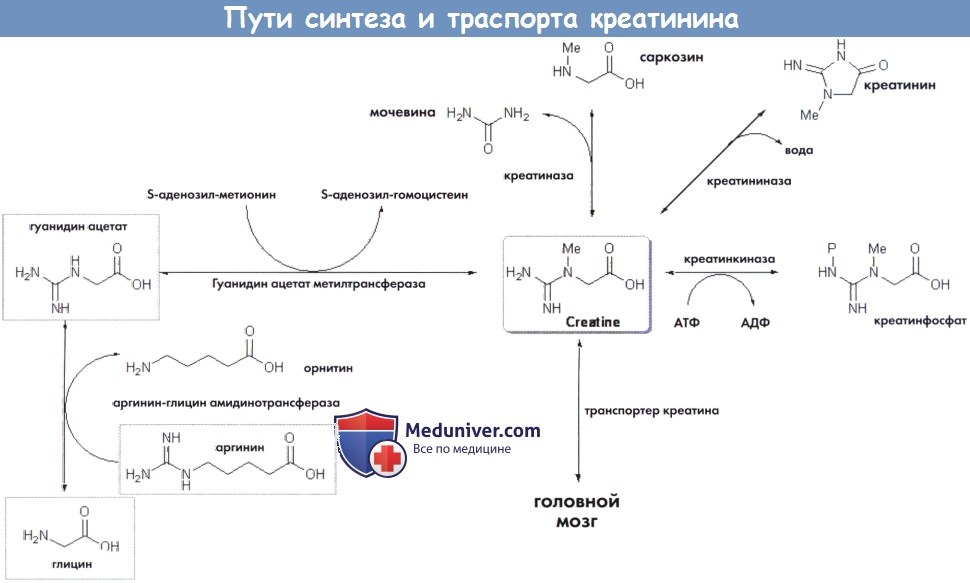
б) Дефицит аргинин: глицин амидинотрансферазы (AGAT). При дефиците AGAT, впервые описанном в 2000 г., отклонений на МРТ головного мозга не выявляется, но при МР-спектроскопии обнаруживается полное отсутствие креатина/креатинфосфата. Диагностика дефицита AGAT основана на исследовании фибробластов и лимфоцитов.
У пациентов не отмечалось эпилепсии или других нейромышечных симптомов. Уровень креатина в сыворотке не отличался от нормы, уровень GAA был несколько снижен, а экскреция GAA с мочой — чрезвычайно снижена. У обоих пациентов отмечалась хорошая реакция на лечение креатином (Schulze, 2003).
в) Сцепленный с Х-хромосомой дефицит транспортера креатина (CRT1). Данное заболевание проявляется легкой задержкой умственного развития и тяжелой задержкой развития речи у мальчиков. Не считая легкой гипотонии, двигательные функции не нарушены. При МРТ и МР-спектроскопии отмечается практически полное отсутствие сигнала креатина.
Данное наследственное нарушение метаболизма вызвано генетическим дефектом сцепленного с Х-хромосомой транспортера креатина, локализованного на участке SLC6A8 хромосомы Xq28 (Salomons et al., 2003). Обнаружены не связанные между собой семьи, в которых выявлены мужчины и женщины носители дефектного гена. Клиническими проявлениями дефицита CrT1 является умеренная мышечная гипотония, задержка умственного развития, задержка развития речи и эпилепсия. Концентрация креатина в плазме и моче повышена, уровень GAA не отличается от нормы.
МР-спектроскопия является наиболее целесообразным неинвазивным исследованием. Пероральное применение креатина не проводило к восстановлению нормальной концентрации креатина в головном мозге (по результатам МР-спектроскопии) и не уменьшало выраженность симптомов (Schulze, 2003).
— Вернуться в оглавление раздела «Неврология.»
Редактор: Искандер Милевски. Дата публикации: 16.12.2018
Источник
Изменение креатинкиназы при психических расстройствах
Опубликовано сб, 03/08/2019 — 08:15
Креатинкиназа (СК) катализирует обратимый перенос фосфорильной группы из фосфокреатина в аденозин-5′-дифосфат (АDP), регенерируя, таким образом, аденозинтрифосфат (АТФ, АТP). Креатинкиназа является членом семейства фосфаген киназ.
Фосфокреатин можно рассматривать как резервуар «высокоэнергетического фосфата», который способен поставлять АТФ — основной источник энергии в биоэнергетике, по требованию органов. Следовательно, креатинкиназа играет значительную роль в энергетическом гомеостазе клеток с периодически высокими энергетическими потребностями.
Впервые выявленный в 1928 году, фермент — креатинкиназа , подвергался интенсивному исследованию в течение более 75 лет. Существует четыре основных изозима, два цитозольных и два митохондриальных, которые образуют димеры и октамеры соответственно. В зависимости от рН, данный фермент работает по случайному или упорядоченному бимолекулярному механизму с равновесием, лежащим в направлении выработки фосфокреатина. Имеющиеся данные свидетельствуют о том, что превращение креатина в фосфокреатин происходит посредством поточного переноса фосфорильной группы из АТФ.
Структура креатинкиназы
Выявленная с помощью рентгеновской кристаллографии позволила идентифицировать три структурных аспекта креатинкиназы человеческого мозга (hBB-CK): свободная от лиганда форма при 2,2А; комплекс ADP-Mg2 +, нитрат и креатин (переходно-аналоговое комплексное состояние; TSAC); и ADP-Mg2 + -комплекс при 2,0А. что , подтвердило многие прогнозы, основанные на исследованиях кинетики, спектроскопии и мутагенеза. Структуры связанного с лигандом hBB-CK выявили два разных мономерных состояния в одном гомодимере. Один мономер представляет собой замкнутую форму, связанную либо с TSAC, либо с ADP-Mg2 + -комплексом, а второй мономер представляет собой открытую форму без лигната.
Гены креатинкиназы экспрессируются в нескольких тканях с высоким флуктуирующим обменом энергии, например, в скелетных и сердечных мышцах, клетках мозга и фоторецепторов и сперматозоидах. Было охарактеризовано несколько изоферментов креатинкиназы: изоферменты мозгового, мышечного и гибридного типов, а также митохондриальные изоферменты креатинкиназы.
Значение изменененного уровня креатинкиназы при психических расстройствах
Измерение уровня креатинкиназы в сыворотке является рутинным тестом в диагностике острого инфаркта миокарда и различных мышечных нарушений. Повышение уровня CK в сыворотке у пациентов с психическими расстройством является довольно неспецифическим явлением. Чаще всего повышенный уровень креатинкиназы в сыворотке крови обусловлен внутримышечными инъекциями, дистонические реакции, использованием ограничений, или другой интенсивной изометрической активностью.
Несмотря на то, что до сих пор спорным является тот факт , повышенная активность креатинкиназы отражает один из основных критериев злокачественного нейролептического синдрома. Несмотря на многочисленные исследования о значении креатинкинизы в постнатальном мозге и патогенезе психических расстройств, ее роль в психиатрии остается загадочной.
Повышенные уровни креатинкиназы в сыворотке часто встречаются в практике врача психиатра , работающего в стационаре. Хотя большинство случаев являются доброкачественными и временными, важно своевременно распознавать и лечить эти состояния. Наиболее распространенные этиологические факторы (отпускаемые по рецепту лекарства, алкоголь, физические причины, поражение сердца) и клинические синдромы (рабдомиолиз, нейролептический злокачественный синдром, острый коронарный синдром) следует учитывать, когда у больных психиатра наблюдается повышенный уровень креатинкиназы. Рутинные измерения креатинкиназы у бессимптомных пациентов, принимающих антипсихотические препараты, не рекомендуются, но следует тщательно следить за развитием рабдомиолиза у пациентов, когда возникают симптомы поражения мышц.
Массовое бессимптомное повышение уровня креатинкиназы
Массовое бессимптомное повышение уровня креатинкиназы (MACKE) было описано во время антипсихотического лечения у многих взрослых пациентов во время психоза без признаков нейролептического злокачественного синдрома (NMS)
Обнаружение MACKE должно указывать на необходимость еженедельного мониторинга уровня креатинкиназы, только когда есть основания полагать, что ее повышенный уровень является токсичным или вредным. Дальнейшие исследования рекомендуется проводить тогда , когда клинические симптомы вызывают подозрение на NMS или рабдомиолиз, включая гриппоподобный синдром, повышение температуры, слабость, изменение сознания, ригидность мышц, тахикардию, гипер- / гипотензию и темную мочу. Прекращение приема лекарств следует рассматривать в тех случаях, когда подозреваются возможные признаки NMS или рабдомиолиза, или в случаях очень высоких и постоянных уровней креатинкиназы. Эмпирические данные указывают на то, что не существует «безопасного» антипсихотического препарата; поэтому переключение на другой антипсихотик с другим профилем не обязательно является безопасным вариантом. Спонтанно ремиттирующий или прерывистый курс предполагает, что «истинный» MACKE должен отличаться как от рабдомиолиза, так и от NMS
Источник
