Две группы крыс подвергли иммобилизационному стрессу

1. Оцените каждый показатель.
2. Сделайте заключение о типе желудочной секреции
3. Как изменяются функции ЖКТ при данной патологии?
4. Ваш предположительный диагноз.
Две группы крыс подвергли иммобилизационному стрессу. При этом
одну группу содержали на естественном питании, а другую ‒ на паренте-
ральном. У животных обеих групп сформировались язвы желудка.
1. Объясните механизм возникновения стресс-язв.
2. В какой группе условия для развития язв желудка лучше и почему?
3. Чем отличаются стресс-язвы от язвенной болезни?
При иммуноцитохимическом исследовании биоптата слизистой оболоч-
ки антрального отдела желудка у больного с множественными язвами желуд-
ка и 12-перстной кишки выявлено резкое увеличение количества
1. Каким образом эти изменения можно связать с язвообразованием?
2. Как называется данный синдром?
3. Каковы основные его проявления и их механизмы развития?
Дайте оценку следующим лабораторным анализам:
Источник
Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 248-257
Морфофункциональные аспекты повреждения сердца при иммобилизационном стрессе у крыс
Е. С. Прокудина 1 , А. С. Горбунов 1 , В. А. Казаков 2 , В. В. Саушкин 1 , H. Ma 3 , Л. Н. Маслов 1, *
1 Томский национальный исследовательский медицинский центр
Томск, Росcия
2 Филиал Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Московская область, Пущино, Россия
3 Хебейский медицинский университет
Шиджиажуан, Китай
Поступила в редакцию 11.12.2018
После доработки 07.02.2019
Принята к публикации 07.02.2019
Исследование было проведено на крысах, которых подвергали иммобилизационному стрессу (24 ч). Установлено, что стресс приводит к гипертрофии надпочечников, инволюции тимуса, селезенки, появлению язв желудка, увеличению уровня кортизола и кортикостерона в сыворотке крови. Одновременно в 12 раз возрастает аккумуляция 99m Tc-пирофосфата в сердце. В экспериментах на изолированном перфузируемом сердце крыс было показано, что стресс приводит к уменьшению давления, развиваемого левым желудочком, и увеличению конечного диастолического давления, но не влияет на коронарный проток. Морфологическое исследование показало, что стресс вызывает появление сегментарной контрактуры, интерстициального отека, кариопикноза. Стресс не влиял на уровень креатинфосфокиназы (КФК) в перфузате, оттекающем от сердца, уровень КФК в сыворотке крови и показатели ЭКГ.
В 1977 г. было показано, что стресс, вызванный с помощью электростимуляции конечностей (food-shock stress), может вызывать у крыс поражения сердца, сходные с кардиомиопатией [1]. В 1990 г. стресс-индуцированная кардиомиопатия была описана у человека [2]. Авторы назвали такую патологию “синдромом тако-тсубо” (СТ), поскольку левый желудочек сердца пациентов с СТ во время систолы принимал форму ловушки для осьминогов, которую называют в Японии “tako-tsubo” [2]. Позднее было показано, что для стрессовой кардиомиопатии характерна сократительная дисфункция, повышение в крови уровня маркеров некроза миокарда, подъем или депрессия сегмента ST, инверсия зубца Т и удлинение интервала QTc [3–7]. Отмечаются ли подобные изменения при стресс-индуцированной кардиомиопатии у животных, оставалось неясным.
Благодаря улучшению методов диагностики, выявляемость случаев СТ за последние годы возросла. Так, согласно данным R. Khera и соавт. [8] с 2007 по 2012 гг. заболеваемость СТ в США возросла в 3 раза (с 53 до 178 случаев на 1 млн госпитализированных пациентов). Летальность при СТ в течение 28 дней после госпитализации сопоставима с таковой у пациентов с острым инфарктом миокарда (ОИМ) и подъемом сегмента ST (5.5% против 5.7%), а количество умерших больных СТ в течение 1 года составляет 12.5% [9]. По другим данным внутригоспитальная летальность при СТ достигает 3.5–4.4% [6, 10]. Такой высокий процент летальных исходов при СТ объясняется ограниченностью наших знаний о патогенезе стрессорной кардиомиопатии и, соответственно, отсутствием эффективной патогенетически обоснованной терапии этого заболевания. Так, например, неизвестно, какие процессы (некроз, некроптоз, апоптоз, аутофагия) лежат в основе патогенеза стрессорной кардиомиопатии. По нашему мнению, исследования на животных могут помочь пониманию механизмов возникновения СТ, а, следовательно, помогут разработать способы лечения этой патологии.
Полагают [11], что иммобилизационный стресс способствует возникновению состояния, подобного СТ. Ранее мы показали, что 24-часовой иммобилизационный стресс (ИС) вызывает аккумуляцию в миокарде крыс радиоактивного 99m Tc-пирофосфата [12], что говорит о диффузном повреждении сердца [1]. Вместе с тем, было неизвестно, может ли подобное воздействие вызвать сократительную дисфункцию сердца, как это имеет место при СТ.
Цель работы: исследовать морфофункциональные аспекты повреждения сердца при иммобилизационном стрессе у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование было выполнено на 117 крысах-самцах линии Вистар массой 300–330 г. Линия крыс была получена из НИИ цитологии и генетики СО РАН (г. Новосибирск). Крыс декапитировали для определения уровня креатинфосфокиназы, гормонов в крови и оценки морфологических изменений сердца. Стресс моделировали путем иммобилизации (24 ч) крыс на спине с помощью стандартных хомутов (АО “ДКС” Тверь, Россия). При подобной фиксации не происходило нарушение кровотока в иммобилизованных конечностях. Крысы голодали в течение 16 ч до стресса, но имели свободный доступ к воде. В группу контроля вошли интактные животные. Животных умерщвляли с помощью цервикальной дислокации для изоляции сердца. Крыс умерщвляли в 11 ч 30 мин утра. Исследование было одобрено этическим комитетом НИИ кардиологии Томского НИМЦ.
После стернотомии сердца быстро иссекали и помещали в бикарбонатный буфер Кребса–Хензелайта (4°) до остановки. Аорту канюлировали для ретроградной перфузии буфером Кребса–Хензелайта при 37°С (в мМ): 120 NaCl, 4.8 KCl, 2.0 CaCl2, 1.2 MgSO4, 1.2 KH2PO4, 20.0 NaHCO3, 10.0 глюкозы. После насыщения буфера смесью газов 95% O2 – 5% CO2 его pH был доведен до 7.4. Каждое сердце перфузировали при постоянном давлении в 52 мм рт. ст. Систолическое и диастолическое давление в левом желудочке регистрировали с помощью датчика давления SS13L (Biopac System Inc., Goleta, Калифорния, США), сопряженного с внутрижелудочковым баллончиком. В ходе опыта регистрировали ЧСС (уд/мин) и давление, развиваемое левым желудочком (ДРЛЖ, мм рт. ст.). Последнее вычисляли как разницу между систолическим и диастолическим давлением. В динамике эксперимента измеряли также конечное диастолическое давление (КДД, мм рт. ст.). Кроме того, определяли максимальную скорость увеличения давления в ЛЖ (+dP/dt, мм рт. ст./с) и максимальную скорость снижения давления в ЛЖ (-dP/dt, мм рт. ст./с). Креатинфосфокиназу определяли энзиматическими наборами компании “Analyticon Biotechnogies AG” (Lichtenfels, Германия). Выброс КФК использовали как индикатор некроза кардиомиоцитов. Оценку уровня КФК проводили на планшетном спектрофотометре Infinete M200 Pro (Tecan, Salzburg, Австрия). В это исследование было включено 24 животных.
Морфологические исследования были выполнены на 46 крысах. Изготовление гистологических препаратов осуществлялось следующим способом: образцы миокарда фиксировали в 10%-ном растворе забуференного формалина (ООО “БиоВитрум”, Санкт-Петербург) в течение 24 ч, промывали в проточной воде и обезвоживали в растворе для гистологической обработки на основе абсолютизированного изопропилового спирта Изопреп (ООО “БиоВитрум”, Санкт-Петербург). После обезвоживания образцы миокарда заливались в гомогенизированную парафиновую среду для заливки BioPlast (“BioOptica”, Италия). Парафиновые срезы толщиной 5–7 мкм, полученные при помощи ротационного механического микротома HM 325 (Thermo Scientific, США), окрашивали гематоксилином и эозином, а также ГОФП-методом (гематоксилин–основной фуксин–пикриновая кислота) по L. Li и соавт. [13], используя красители ООО “БиоВитрум” (Санкт-Петербург). Окрашенные препараты заключали в синтетическую монтирующую среду BioMount (“BioOptica”, Италия). Гистологические препараты изучались с помощью световой микроскопии на микроскопе Axio Lab.A1 (“Carl Zeiss”, Германия). Микрофотографии гистологических препаратов получали с помощью фотокамеры Axiocam 105 color (“Carl Zeiss”, Германия).
В сыворотке крови определяли уровень КФК, кортизола и кортикостерона. Для этого использовали стандартные коммерческие наборы: для определения КФК – наборы компании “Analyticon Biotechnogies AG” (Lichtenfels, Германия); для кортизола – “Cortisol RIA KIT” IM1841 (Beckman Coulter, Immunotech, Прага); для кортикостерона –“Corticosterone (Human, Rat, Mouse) ELISA” RE52211 (IBL International GmbH, Гамбург, Германия). Для определения уровня кортизола использовали радиометр многоканальный РИГ-12 “Прогресс-РИА” (Россия, Санкт-Петербург). Оценку уровня КФК и кортикостерона проводили на планшетном спектрофотометре Infinete M200 Pro (Tecan, Salzburg, Австрия). Определение уровня КФК, кортизола и кортикостерона производили у 27 крыс.
Количественную оценку стрессорного повреждения сердца осуществляли по аккумуляции радиофармпрепарата 99m Tc-пирофосфата ( 99m Tc-ПФ) в миокарде по методу, предложенному D.G. Miller и S. Mallov [1]. Радиофармпрепарат, полученный с помощью генератора технеция TEKCIS (Франция), вводили внутривенно в дозе 150 МБк/кг через 30 мин после прекращения иммобилизации [1]. Через 100 мин после инъекции животных декапитировали под эфирным наркозом. После извлечения из грудной клетки сердце отмывали от крови, перфузируя его холодным (10 о С) физиологическим раствором (10 мл) через аорту. Регистрацию радиоактивности осуществляли с помощью гамма-камеры “Philips Forte” (Philips, Нидерланды). Включение 99m Tc-ПФ в ткань миокарда рассчитывали в процентах от введенной дозы на 1 г ткани. Это исследование было выполнено на 27 крысах. Запись ЭКГ выполняли на аппарате для электрофизиологических исследований MP35 (Biopac System Inc., Goleta, США). Количественную обработку полученных данных проводили с помощью программного обеспечения INSTBSL-W компании B-iopac System Inc., (Goleta, США). Расчет интервала QT, скорректированного на ЧСС, осуществляли согласно рекомендациям A. Van de Water и соавт. [14]. Это исследование был выполнено на 20 крысах.
Статистическую обработку данных проводили с использованием пакетов программы “Statistica 6.0”. Достоверность полученных результатов оценивали по критерию Манна–Уитни. Статистически значимыми считали различия при p 2 использовали для оценки данных морфологического исследования сердца.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Иммобилизационный стресс в наших экспериментах вызывал формирование классической “триады Селье”: инволюция лимфоидной системы (тимус, селезенка), гипертрофия надпочечников (рис. 1А), язвы слизистой желудка. Так, например, масса надпочечников увеличивалась на 20%; масса тимуса, напротив, уменьшалась на 28%; количество язв желудка увеличилось в 6 раз по сравнению с интактными животными. Количество язв желудка на 1 крысу в контроле было равно 0.4 ± 0.4 (n = 13), в группе стресса 6.0 ± 1.6 (n = 14, p = 0.003). Одновременно наблюдалось увеличение уровня кортизола в сыворотке крови на 60% и содержания кортикостерона на 61% (рис. 1Б). Эти факты говорят о том, что при иммобилизации развивается классический общий адаптационный синдром. Если синдром тако-тсубо и стрессовое повреждение сердца у крыс имеют одну и ту же патогенетическую природу, то мы в своих экспериментах должны были бы наблюдать характерные для СТ изменения ЭКГ: смещение сегмента ST, инверсия зубца Т и удлинение интервала QTc [3]. Однако нам не удалось выявить различий по характеру ЭКГ-картины между интактными особями и стрессированными крысами (данные не представлены на рисунке). Это говорит о том, что патогенез СТ у человека и стрессорной кардиомиопатии у крыс может различаться. Вместе с тем следует отметить, что подъем сегмента ST удается обнаружить только у 13–14% больных СТ [5, 15], у 46% пациентов с СТ не удается обнаружить удлинение интервала QTc [16]. Следовательно, изменение показателей ЭКГ не является обязательным условием для стрессорного повреждения сердца.
Рис. 1.
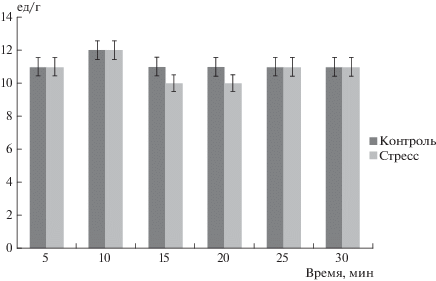
Влияние стресса на массу органов (А) и уровень гормонов в сыворотке крови (Б). * – достоверность относительно аналогичных значений в контроле р 99m Tc-ПФ. В экспериментах на изолированном перфузируемом сердце крысы эти авторы показали, что электроболевой стресс приводит к увеличению в перфузате, оттекающем от сердца, уровня лактатдегидрогеназы (маркер некроза сердца) в 1.5 раза по сравнению с сердцем интактного животного. Как показано на рис. 2, иммобилизационный стресс в наших опытах не повлиял на уровень КФК в перфузате, оттекающем от сердца. Этот факт позволяет говорить о том, что выбранное нами воздействие является более щадящим, в отличие от “жесткого” стресса, использованного D.G. Miller и S. Mallov [1], не вызывает некроза клеток сердца. Кроме того, вполне вероятно, что ИС не идентичен СТ, для которого характерно повышение уровня маркеров некроза в крови пациентов. Нам не удалось обнаружить и увеличения уровня КФК в сыворотке крови иммобилизованных особей: у интактных животных уровень КФК (Ед/л) составлял 1481 ± 401 (n = 13), а у стрессированных крыс – 1636 ± 203 (n = 14, p > 0.05). Следует отметить, что при СТ подъем маркеров некроза носит умеренный характер, так, уровень тропонина Т у пациентов с СТ в 6 раз меньше, чем у пациентов с острым инфарктом миокарда [17]. Некоторые авторы не смогли обнаружить подъем уровня маркеров некроза у пациентов с СТ [18]. В то же время, эксперименты показали, что иммобилизация вызывает увеличение в миокарде аккумуляции 99m Tc-ПФ в 12 раз по сравнению с интактными животными. Удельное включение 99m Тс-ПФ в миокард у контрольных животных составляло 2.16 ± 0.66 МБк/кг, а у стрессированных особей – 25.37 ± 4.33 МБк/кг. Эти факты говорят о том, что при иммобилизации имеет место выраженное повреждение сердца, но без некроза.
Рис. 2.
Влияние стресса на уровень КФК (Ед/г) в перфузате, оттекающем от сердца. В группе контроля n = 12, в группе стресса n = 12 крыс.
Как было отмечено выше, характерной особенностью синдрома тако-тсубо является сократительная дисфункция сердца [2, 3]. Согласно результатам клинических наблюдений [19] у пациентов с СТ отмечается увеличение конечного диастолического давления левого желудочка (КДД ЛЖ) и усиление диастолической жесткости миокарда. По данным контрастной эхокардиографии [20], у больных при синдроме тако-тсубо удается выявить микроциркуляторную дисфункцию, которая, как полагают, вызвана вазоспазмом мелких коронарных сосудов [3]. Исходя из сказанного, в экспериментах на изолированном перфузируемом сердце мы ожидали обнаружить увеличение КДД ЛЖ, уменьшение ДРЛЖ и снижение коронарного протока. Действительно, ДРЛЖ в наших экспериментах уменьшалось в среднем на 20%, а КДД увеличивалось до максимальных значений (+29%) на 30-минуте перфузии (табл. 1). Максимальная скорость сокращения и расслабления ЛЖ снижалась соответственно на 15% и на 26% на 15-минуте перфузии (табл. 1). Эти данные совпадают с распространенным мнением о развитии систолической и диастолической дисфункции сердца у пациентов с СТ [12, 19]. Однако нам не удалось обнаружить снижения коронарного протока, тогда как у пациентов с СТ имеет место коронарный вазоспазм [3, 20]. Этот факт может говорить о том, что природа стрессорной кардиомиопатии у человека и крыс может различаться. Вместе с тем, хотелось бы обратить внимание на то, что мы оценивали коронарный проток в опытах in vitro. Следовательно, в нашем случае речь идет о денервированном органе, на который не влияют циркулирующие в крови гуморальные факторы. Представляется вполне вероятным, что коронароспазм у пациентов с СТ имеет нейрогенную природу или является следствием воздействия на коронарные артерии циркулирующих в крови гуморальных факторов.
Таблица 1.
Влияние стресса на параметры сократимости сердца и коронарный проток
| Давление, развиваемое левым желудочком ( мм рт.ст.) | Частота сердечных сокращений (уд/мин) | Конечное диастолическое давление (мм рт.ст.) | Максимальная скорость сокращения (мм рт. ст./с) | Максимальная скорость Расслабления (мм рт. ст./с) | Коронарный проток (мл/мин) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| контроль n = 12 | стресс n = 12 | контроль n = 12 | стресс n = 12 | контроль n = 12 | стресс n = 12 | контроль n = 12 | стресс n = 12 | контроль n = 12 | стресс n = 12 | контроль n = 12 | стресс n = 12 | |
| 10-я мин | 73.7 ± ± 3.5 | 56.7 ± ± 3.1** | 197.3 ± ± 2.3 | 200 ± ± 5 | 15.2 ± ± 0.3 | 15.7 ± ± 0.49 | 1532 ± ± 61 | 1336 ± ± 69** | –1201 ± ± 38 | –1098 ± ± 52** | 13.2 ± ± 0.4 | 12.2 ± ± 0.4 |
| 20-я мин | 73.6 ± ± 1.2 | 57.9 ± ± 3.2** | 208.3 ± ± 3.4 | 194.8 ± ± 9.1 | 13.5 ± ± 0.22 | 16.5 ± ± 0.5** | 1642 ± ± 31 | 1399 ± ± 66** | –1222 ± ± 29 | –904 ± ± 41** | 11.7 ± ± 0.5 | 10.7 ± ± 0.7 |
| 30-я мин | 75.1 ± ± 0.9 | 60.8 ± ± 2.9** | 214.6 ± ± 2.2 | 195.3 ± ± 9 | 13 ± ± 0.25 | 16.8 ± ± 0.6** | 1668 ± ± 32 | 1444 ± ± 84** | –1253 ± ± 28 | –876 ± ± 64** | 10.6 ± ± 0.2 | 9.9 ± ± 0.5 |
* – достоверность относительно аналогичных значений в контроле р 0.05
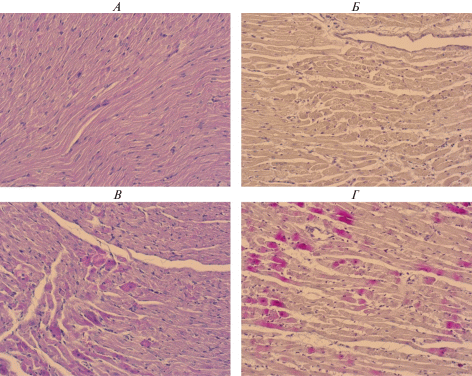
Рис. 3.
Морфологическая картина стресс-индуцированного повреждения сердца. А и Б – Интактный миокард левого желудочка животного из контрольной группы. Окраска гематоксилином и эозином (А) и ГОФП (Б). В – Миокард левого желудочка животного, перенесшего иммобилизационный стресс в течение 24 ч: отдельные кардиомиоциты с пикнотичными ядрами и эозинофильной цитоплазмой, что соответствует светооптическим признакам апоптоза. Окраска гематоксилином и эозином. Г – Миокард левого желудочка животного, перенесшего иммобилизационный стресс в течение 24 ч: фуксинофильный субстрат в цитоплазме кардиомиоцитов с контрактурными повреждениями миофибрилл. Окраска ГОФП. Увеличение 100×.
Таким образом, представленные данные свидетельствуют о том, что стрессовое повреждение сердца у крыс характеризуется нарушением систолической и диастолической функции и умеренным интерстициальным отеком, то есть такими изменениями миокарда, которые сходны с признаками синдрома тако-тсубо у человека. В то же время, у стрессированных крыс не отмечается смещения сегмента ST, инверсии зубца Т, удлинения интервала QTc, снижения коронарного протока и признаков некроза кардиомиоцитов, то есть тех изменении, которые характерны для стрессовой кардиомиопатии у человека. Основной причиной гибели кардиомиоцитов при иммобилизационном стрессе, по всей видимости, является апоптоз кардиомиоцитов.
Источник