Radical-free biology of oxidative stress
Affiliation
- 1 Division of Pulmonary, Allergy and Critical Care Medicine, Clinical Biomarkers Laboratory, Department of Medicine, Emory University School of Medicine, Atlanta, Georgia 30322, USA. dpjones@emory.edu
- PMID: 18684987
- PMCID: PMC2575825
- DOI: 10.1152/ajpcell.00283.2008
Free PMC article
Radical-free biology of oxidative stress
Author
Affiliation
- 1 Division of Pulmonary, Allergy and Critical Care Medicine, Clinical Biomarkers Laboratory, Department of Medicine, Emory University School of Medicine, Atlanta, Georgia 30322, USA. dpjones@emory.edu
Abstract
Free radical-induced macromolecular damage has been studied extensively as a mechanism of oxidative stress, but large-scale intervention trials with free radical scavenging antioxidant supplements show little benefit in humans. The present review summarizes data supporting a complementary hypothesis for oxidative stress in disease that can occur without free radicals. This hypothesis, which is termed the «redox hypothesis,» is that oxidative stress occurs as a consequence of disruption of thiol redox circuits, which normally function in cell signaling and physiological regulation. The redox states of thiol systems are sensitive to two-electron oxidants and controlled by the thioredoxins (Trx), glutathione (GSH), and cysteine (Cys). Trx and GSH systems are maintained under stable, but nonequilibrium conditions, due to a continuous oxidation of cell thiols at a rate of about 0.5% of the total thiol pool per minute. Redox-sensitive thiols are critical for signal transduction (e.g., H-Ras, PTP-1B), transcription factor binding to DNA (e.g., Nrf-2, nuclear factor-kappaB), receptor activation (e.g., alphaIIbbeta3 integrin in platelet activation), and other processes. Nonradical oxidants, including peroxides, aldehydes, quinones, and epoxides, are generated enzymatically from both endogenous and exogenous precursors and do not require free radicals as intermediates to oxidize or modify these thiols. Because of the nonequilibrium conditions in the thiol pathways, aberrant generation of nonradical oxidants at rates comparable to normal oxidation may be sufficient to disrupt function. Considerable opportunity exists to elucidate specific thiol control pathways and develop interventional strategies to restore normal redox control and protect against oxidative stress in aging and age-related disease.
Figures
Two mechanisms of oxidative stress.…
Two mechanisms of oxidative stress. Oxidative stress is defined as an imbalance in…
Sulfur switches (SH) provide flexible…
Sulfur switches (SH) provide flexible control mechanisms for protein function. Cysteine (Cys) is…
Orthogonal regulation can occur through…
Orthogonal regulation can occur through multiple Cys residues on a single protein. Thioredoxin-1…
Glutathionine (GSH) redox network. A…
Glutathionine (GSH) redox network. A partial list of GSH-dependent proteins illustrates the need…
A partial list of proteins…
A partial list of proteins in the Trx redox network. 1 ) Thioredoxins…
Kinetic limitation in a thiol-disulfide…
Kinetic limitation in a thiol-disulfide electron transfer pathway. Measurement of the fractional reduction…
Steady-state redox potential ( E…
Steady-state redox potential ( E h ) values for thiol-disulfide couples within different…
Scheme depicting possible organization of…
Scheme depicting possible organization of Trx- and GSH-dependent pathways into redox control networks.…
Redox-sensitive steps in hypothetical redox…
Redox-sensitive steps in hypothetical redox signaling pathways. Accumulated research from multiple investigators provides…
Источник
Дин джонс оксидативный стресс
П.А. Ховхаева, Н.В. Тютюнник, А.М. Красный, О.А. Сергунина, Л.А. Тимофеева, Н.Е. Кан, В.Л. Тютюнник
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России, Москва
Окислительный стресс (ОС) обеспечивает иммунологическую толерантность во время беременности. Однако чрезмерно высокий уровень активных форм кислорода (AФК) или недостаток ферментов антиоксидантной защиты может вызывать неизбирательное повреждение биологических молекул, нарушать функции или приводить к клеточной смерти [1]. Так, при преэклампсии (ПЭ) уровень ОС и системного воспаления при ПЭ может изменяться в отличие физиологической беременности [2]. По данным L. Myatt и X. Cui [3], G.J. Burton и соавт. [4], ОС развивается на ранних этапах формирования ПЭ.
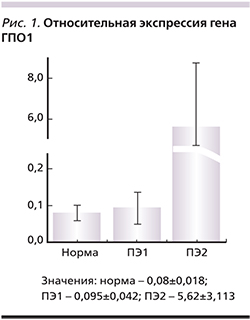
Глутатион и ферменты его метаболизма – одна из важнейших антиоксидантных систем, защищающих ткани от воспаления различной природы [5]. Увеличение ОС вызывает значительное усиление экспрессии генов глутатионпероксидазы-1 (ГПО1) и глутатионредуктазы (ГР) [6]. Нехватка ГПО1 во время беременности может вызывать значительное увеличение перекисей липидов, вызывать эндотелиальную дисфункцию и развитие ПЭ [7, 9]. Таким образом, актуально исследование ОС и уровня антиоксидантной защиты в развитии ПЭ.
 Материал и методы
Материал и методы
В исследование была включена 31 пациентка. Все пациентки были разделены на 2 группы: I (основную группу) составили 11 беременных с ПЭ, II (группа сравнения) – 20 условно здоровых пациенток. Проведены исследования уровня АФК и антиоксидантной защиты с помощью прибора FORM 3000 (Каллегари, Италия) с использованием тестов FORT, FORD соответственно и экспрессии генов методом qPCR.
Критерием включения в исследование для основной группы служила одноплодная беременность, наступившая в естественном цикле, осложненная ПЭ, для группы сравнения – неосложненное течение данной одноплодной беременности, наступившей в естественном цикле.
Критерии исключения были общими: многоплодная беременность, острые воспалительные заболевания, тяжелая экстрагенитальная патология, аутоиммунные и онкологические заболевания.
Выделение и анализ мРНК. Из каждой плаценты было взято по два фрагмента (из средней части, исключая поверхностные слои) для дальнейшего выделения РНК. Ткань помещали в раствор RNAlater для стабилизации РНК и замораживали при -80°С. Перед лизированием образцы нарезали на криостате для обеспечения равномерного лизиса как трофобласта, так и стромальных клеток. Выделение РНК проводили с использованием набора Синтол (ЕХ-515-50), согласно рекомендациям производителя. Обратную транскрипцию для получения кодирующей ДНК ставили при помощи набора Синтол, согласно рекомендациям производителя (Синтол, «ОТ-1»). В исследованиях использовали праймеры к мРНК транскриптам ГПО1, глутатионредуктазы (ГР) и RPL19 (референсный ген). Для проведения ПЦР использовали набор Синтол (М-428). Для реакции был использован амплификатор Real-Time PCR Detection System CFX96 («Bio Rad», USA). Условия проведения ПЦР следующие: 1 – предварительный нагрев 5 минут; 2 – 45 циклов (10 секунд – 95°С, 30 секунд – 60°С).
Уровень АФК и антиоксидантной защиты был определен с помощью прибора FORM 3000 (Каллегари, Италия) с использованием тестов FORT, FORD соответственно. Тест FORT основан на способности ионов железа катализировать в присутствии гидроперекисей (ROOH) образование свободных радикалов кислорода, при связывании которых производное амина CrNH2 образует устойчивое окрашенное соединение. Интенсивность окраски прямо коррелирует с уровнем АФК в исследуемом образце. Тест FORD основан на взаимодействии предварительно образованных окрашенных радикалов с антиоксидантами исследуемого образца. Интенсивность окраски обратно коррелирует с уровнем антиоксидантов в исследуемом образце. Уровень АФК представлен в виде эквивалентного количества перекиси водорода (Н2О2, ммоль/л), уровень антиоксидантов представлен в виде эквивалентного количества антиоксиданта тролокса (тролокс, ммоль/л).
В качестве исследуемого материала была использована сыворотка венозной крови, полученная путем центрифугирования при 800 g в течение 10 минут при 4°С. Для забора крови использованы стандартные пробирки с гепарином в качестве антикоагулянта. От момента забора крови до проведения тестов проходило не более 30 минут. Тесты проводились согласно инструкции изготовителя.
Статистическая обработка результатов qPCR. Эффективность полимеразной цепной реакции (ПЦР) для каждой пары праймеров была рассчитана при помощи программного обеспечения амплификатора Real-Time PCR Detection System («Bio Rad», USA). Эффективность ПЦР реакции для используемых праймеров была не ниже 1,8. Относительная концентрация исследуемого гена рассчитана по формуле: Сrel target=Сtarget/Сref=(Eref)ct ref/(Etarget)Ct target.
Статистическую обработку результатов проводили при помощи программы «OriginPro 8». Значимость различий между выборками оценивали с использованием однофакторного дисперсионного анализа (ANOVA) со значением p
- Redman C.W., Sargent I.L. Pre-eclampsia, the placenta and the maternal systemic inflammatory response – a review. Placenta. 2003;24(Suppl. A):21–7.
- Redman C.W., Sargent I.L. Placental stress and pre-eclampsia: a revised view. Placenta. 2009;30(Suppl. A):38–42.
- Myatt L., Cui X. Oxidative stress in the placenta. Histochem. Cell. Biol. 2004;122(4):369–82.
- Burton G.J., Yung H.W., Cindrova-Davies T., Charnock-Jones D.S. Placental endoplasmic reticulum stress and oxidative stress in the pathophysiology of unexplained intrauterine growth restriction and early onset preeclampsia. Placenta. 2009;30(Suppl. A):43–8.
- Stehbens W.E. Oxidative stress in viral hepatitis and AIDS. Exp. Mol. Pathol. 2004;77(2):121–32.
- Iskusnykh I.Y., Popova T.N., Agarkov A.A., Pinheiro de Carvalho M.A., Rjevskiy S.G. Expression of glutathione peroxidase and glutathione reductase and level of free radical processes under toxic hepatitis in rats. J. Toxicol. 2013;2013:870628.
- Hubel C.A., Roberts J.M., Taylor R.N., Musci T.J., Rogers G.M., McLaughlin M.K. Lipid peroxidation in pregnancy: new perspectives on preeclampsia. Am. J. Obstet. Gynecol. 1989;161(4):1025–34.
- Sandstrom P.A., Mannie M.D., Buttke T.M. Inhibition of activation-induced death in T cell hybridomas by thiol antioxidants: oxidative stress as a mediator of apoptosis. J. Leukoc. Biol. 1994;55(2):221–26.
- Can M., Guven B., Bektas S., Arikan I. Oxidative stress and apoptosis in preeclampsia. Tissue Cell. 2014;46(6):477–81.
- Lappas M., Mitton A., Peеrmezel M. In response to oxidative stress, the expression of inflammatory cytokines and antioxidant enzymes are impaired in placenta, but not adipose tissue, of women with gestational diabetes. J. Endocrinol. 2010;204(1):75–84.
Об авторах / Для корреспонденции
В.Л. Тютюнник – д.м.н., зав. акушерским физиологическим отделением ФГБУ НЦ АГиП им. акад. В.И. Кулакова Минздрава России, Москва; тел. 8 (438) 09-88; e-mail: v_tioutiounnik@oparina4.ru
Источник
Роль оксидативного стресса в развитии дисфункции эндотелия
Дата публикации: 17.01.2020 2020-01-17
Статья просмотрена: 134 раза
Библиографическое описание:
Беляков, Е. С. Роль оксидативного стресса в развитии дисфункции эндотелия / Е. С. Беляков, Е. Ю. Мельничук. — Текст : непосредственный // Молодой ученый. — 2020. — № 3 (293). — С. 95-96. — URL: https://moluch.ru/archive/293/66172/ (дата обращения: 12.10.2021).
В данном обзоре рассматривается влияние оксидативного стресса на формирование и прогрессирование эндотелиальной дисфункции.
Ключевые слова: эндотелиальная дисфункция, оксидативный стресс, оксид азота, эндотелий.
В настоящие время одной из основных причин смертности в мире выступают заболевания сердечно-сосудистой системы, в патогенезе которых немаловажную роль занимает такое состояние как эндотелиальная дисфункция (ЭД).
Эндотелий считается индикатором сердечно-сосудистого здоровья, именно в его структуре и функциях происходят первые изменения в ответ на повреждающие факторы. Он обеспечивает саморегуляцию сосудистой системы в ответ на стимулы различной природы, выделяет вазоактивные молекулы, которые контролируют просвет сосуда, пролиферацию и сокращение гладкой мускулатуры, входящей в состав сосудистой стенки, активацию тромбоцитов и адгезию лейкоцитов. При длительном неблагоприятном воздействии различных факторов формируется эндотелиальная дисфункция.
В современном представлении эндотелиальная дисфункция — это дисбаланс между образованием вазодилатирующих, атромбогенных, антипролиферативных факторов, с одной стороны, и вазоконстриктивных, протромботических и пролиферативных веществ, которые синтезирует эндотелий, — с другой [4].
Причиной возникновения и прогрессирования данного дисбаланса может быть оксидативный стресс, который представляет собой патологическое состояние, при котором нарушаются механизмы антиоксидантной зашиты организма и происходит образование большого количества активных форм кислорода (АФК).
Большинство АФК имеют неспаренный электрон, благодаря чему обладают высокой химической активностью. К ним относятся супероксидный анион (O 2- ), гидроксильный радикал (HO•), оксид азота (NO•) и липидные радикалы. Другие АФК, такие как перекись водорода (Н2О2), пероксинитрит (ONOO – ), гипохлорная кислота (HOCl), по сути, не свободные радикалы, но они также обладают высокой окислительной активность [2].
Основным звеном, на которое воздействует оксидативный стресс является оксид азота (NO) синтезируемый эндотелием сосудов. NO синтезируется из L-аргинина благодаря эндотелиальной синтазе оксида азота (eNOS) [5]. Молекула eNOS состоит из димера с ядром тиолата цинка (ZnS 4) и активируется в присутствии молекулярного кислорода (O2) и кофакторов гема, тетрагидробиоптерина (BH 4), флавинаденина мононуклеотида (FMN), флавинаденина динуклеотида (FAD) и НАДФН [8].
При формировании избыточного количества АФК происходят следующие нарушения в структуре и функциях эндотелия:
1) Перекисное окисление липидов, в особенности, окисленные липопротеиды низкой плотности стимулируют синтез кавеолина-1, который подавляет образование NO путем инактивации eNOS [2]
2) Дисрегуляция активации eNOS приводит к порочному циклу производства АФК, где сам eNOS считается непосредственным источником АФК. Вместо NO начинает синтезироваться супероксид анион (O 2− ). Он быстро соединяется с оксидом азота с образованием активных форм азота, пероксинитрита (ONOO − ), тем самым уменьшая биодоступность NO [8].
3) Существует несколько ферментных систем, которые потенциально могут производить АФК в стенке сосуда. К ним относятся НАДФН-оксидазы, ксантиноксидаза, ферменты митохондриальной дыхательной цепи. Из них НАДФН-оксидазы имеют первостепенное значение для генерации АФК [7].
Например, пероксинитрит (ONOO − ) быстро генерируется в результате реакции между O 2− и NO и потенцирует расцепление eNOS [8]. Окисление тетрагидробиоптерина до дигидробиоптерина с помощью ONOO – и H 2 O 2 ограничивает доступность субстрата eNOS [8].
Из вышесказанного можно заключить, что основным механизмом воздействия является превращение eNOS из NO-продуцирующего фермента в фермент, который генерирует O 2 − [7]. Таким образом возникает самоподдерживающий процесс, в котором сложно выделить начало, так оксидативный стресс может быть начальным звеном формирования ЭД и в свою очередь ЭД, индуцированная другими факторами, так же может запускать механизмы образования АФК, что будет приводить к окислительному стрессу эндотелия.
- Барбараш О. Л., Кашталап В. В., Каретникова В. Н., Воронцова Н. Л., Девятова В. А., Гончаренко М. В., Барбараш Л. С. Клиническая значимость показателей эндотелиальной дисфункции, оксидативного стресса и гемостаза у больных инфарктом миокарда // Патология кровообращения и кардиохирургия. — 2007. — № 2. — С. 28–33.
- Булаева Н. И., Голухова Е. З. Эндотелиальная дисфункция и оксидативный стресс: роль в развитии кардиоваскулярной патологии // Креативная кардиология. — 2013. — № 1. — С. 14–21.
- Лупач Н. М., Потапов В. Н.,Хлудеева Е. А., Баофен Я., Артюков А. А., Лукьянов П. А. Оксидантный статус и эндотелиальная дисфункции у больных стабильной стенокардией // бюллетень физиологии и патологии дыхания. — 2007. — № 25. — С. 51–53.
- Мельникова Ю. С., Макарова Т. П. ЭНДОТЕЛИАЛЬНАЯ ДИСФУНКЦИЯ КАК ЦЕНТРАЛЬНОЕ ЗВЕНО ПАТОГЕНЕЗА ХРОНИЧЕСКИХ БОЛЕЗНЕЙ // Казанский медицинский журнал, — 2015. — № том 96, № 4. — С. 659–665.
- Arijit Ghosh, Lei Gao, Abhimanyu Thakur, Parco M. Siu, Christopher W. K. La. Role of free fatty acids in endothelial dysfunction // Journal of Biomedical Science. — 2017. — № 24.
- Donato AJ, Morgan RG, Walker AE, Lesniewski LA. Cellular and molecular biology of aging endothelial cells. J Mol Cell Cardiol. 2015;89:122–135.
- Forstermann, U.; Sessa, W. C. Nitric oxide synthases: Regulation and function. Eur. Heart J. 2012, 33, 829–837.
- Meza C. A., La Favor J. D., Kim D. H., Hickner R. C. Endothelial Dysfunction: Is There a Hyperglycemia-Induced Imbalance of NOX and NOS // International Journal of Molecular Sciences. — 2019. — № 20(15). — С. 3775.
- Avogaro A, de Kreutzenberg SV. Mechanisms of endothelial dysfunction in obesity. Clin Chim Acta. 2005;360(1):9–26
Источник









 Материал и методы
Материал и методы