Часть мозга отвечающая за чувство голода
Пищеварительная система является частью более сложной системы — функциональной системы питания, обеспечивающей сложное пищедобывательное поведение и поддерживающей относительно постоянный уровень содержания питательных веществ в организме.
В процессе метаболизма клеток происходит постоянное потребление ими питательных веществ. Снижение концентрации питательных веществ в крови приводит к возникновению у животных и человека неприятного чувства голода, которое является субъективным выражением потребности организма в пище. Физиологической основой для чувства голода является возбуждение центра голода, локализованного в латеральных ядрах гипоталамуса.
Чувство голода является побудительной причиной (мотивацией) целенаправленной пищедобывательной деятельности (поиска и приема пищи). При электростимуляции через вживленные электроды (в опытах на животных) латеральных ядер гипоталамуса возникает чрезмерная потребность в пище (гиперфагия), а при их разрушении — отказ от приема пищи (афагия). Мощным стимулятором центра голода является кровь с пониженным содержанием глюкозы, аминокислот, жирных кислот и глицеридов, продуктов метаболизма цикла Кребса. Она возбуждает ядра латерального гипоталамуса через хемо-рецепторы сосудов и рецепторы самого гипоталамуса, избирательно чувствительные к недостатку в крови определенных питательных веществ.
После приема пищи у животного и человека возникает субъективно приятное чувство насыщения, сменяющее чувство голода и прекращающее потребление пищи. Чувство насыщения является следствием возбуждения центра насыщения, расположенного в вентромедиальных ядрах гипоталамуса. Между центрами голода и насыщения имеются реципрокные отношения (возбуждение одного сопровождается торможением другого).
Чувство насыщения, прекращающее прием пищи, имеет нейрогенную природу и обусловлено поступлением афферентных импульсов от раздражаемых пищей рецепторов проксимальных отделов пищеварительного тракта (слизистых оболочек и мускулатуры полости рта, пищевода и желудка). Эта афферентация возбуждает центр насыщения и тормозит центр голода. Она является причиной сенсорного насыщения (первичного) и предшествует увеличению питательных веществ в крови.
Через 1,5—2 ч после приема пищи исходный уровень содержания питательных веществ в крови восстанавливается за счет их поступления из органов, в которых они находятся в депонированном состоянии.
Так, превращение гликогена печени в глюкозу приводит к возрастанию ее концентрации в крови. Это обусловливает гуморальное возбуждение центра насыщения, что является причиной метаболического (обменного, вторичного) насыщения.
Поддержание уровня концентрации питательных веществ в крови осуществляется за счет поступления из желудочно-кишечного тракта продуктов гидролиза пищевых веществ.
Источник
Часть мозга отвечающая за чувство голода
а) Регуляция потребления пищи и запасания энергии. Для поддержания постоянной массы и структуры тела в течение длительного времени необходимо поддержание баланса прихода и расхода энергии. Как говорилось в отдельной статье на сайте (просим вас пользоваться формой поиска выше), только 27% поступившей энергии используются функциональными системами клеток, большая часть преобразуется в тепловую энергию, которая получается в результате метаболизма белка, активности мышц, деятельности различных органов тканей. Избыток поступившей в организм энергии хранится главным образом в виде жира. Дефицит поступления энергии с пищей сопровождается потерей массы тела до тех пор, пока приход энергии не станет равен ее расходу.
Поддержание нормального уровня обеспечения энергией необходимо для сохранения жизни, поэтому организм наделен мощными физиологическими системами контроля, помогающими поддерживать необходимое поступление энергии. Но существует значительная вариабельность количества запасаемой энергии (т.е. количества запасаемого жира) у различных индивидуумов. Так, возникший дефицит энергетических запасов у спортсменов и рожениц приводит к быстрой активации механизмов формирования чувства голода, побуждающего к поиску пищи. В связи с очень высокой мышечной активностью расход энергии может составлять 6000-7000 Ккал по сравнению с 2000 Ккал, необходимыми для лиц, ведущих сидячий образ жизни. Таким образом, большой расход энергии, связанный с тяжелой мышечной работой, обычно стимулирует равное увеличение поступления энергии.
Каковы же физиологические механизмы, улавливающие изменение энергетического баланса и влияющие на поиск пищи? Поддержание адекватного обеспечения организма энергией — очень важная задача, поэтому существуют многообразные кратко- и долговременные контролирующие системы, которые регулируют не только потребление пищи, но и расход, и запасание энергии. В следующих разделах мы изложим некоторые из этих систем, их работу в физиологических условиях при ожирении и истощении.
б) Нервные центры, регулирующие потребление пищи. Чувство голода сочетается с сильным желанием есть и различными другими физиологическими изменениями — ритмическими сокращениями желудка и беспокойством, которое заставляет человека искать необходимую пищу. После приема пищи наступает чувство насыщения. Каждое из этих ощущений формируется под влиянием окружающей среды и социальных факторов; кроме того, ими управляют особые центры мозга, главным образом гипоталамус. Аппетит представляет собой стремление к определенному виду пищи и полезен для осуществления ее выбора.
в) В гипоталамусе присутствуют центры голода и насыщения. Некоторые центры гипоталамуса принимают участие в регуляции потребления пищи. Так, латеральные ядра гипоталамуса являются центрами голода, стимуляция которых приводит к прожорливости (гиперфагии). Напротив, разрушение этих структур сопровождается отказом от еды и нарастающим истощением (состоянием, которое характеризуется заметной потерей веса, мышечной слабостью, снижением метаболизма). Центр голода реализует свои влияния путем формирования побуждения, направленного на поиск пищи.
Вентромедиальные ядра гипоталамуса относятся к центру насыщения. Предполагают, что этот центр ответствен за чувство насыщения, тормозящее центр голода. Электрическая стимуляция этих структур сопровождается формированием чувства насыщения, и животное отказывается от пищи (афагия), даже если ему предлагают очень аппетитную еду. Напротив, разрушение вентромедиальных ядер гипоталамуса сопровождается прожорливостью и непрерывным потреблением пищи, что приводит к крайнему ожирению. Вес животных иногда в 4 раза превышает норму. Паравентрикулярные, дорсомедиальные и аркуатные ядра гипоталамуса также играют заметную роль в регуляции потребления пищи. Например, повреждение паравентрикулярных ядер часто сопровождается чрезвычайной прожорливостью, в то время как повреждение дорсомедиальных ядер обычно подавляет пищевое поведение. Как будет изложено далее, аркуатные ядра гипоталамуса являются областью, к которой поступают многочисленные гормоны желудочно-кишечного тракта и жировой ткани для управления как пищевым поведением, так и расходом энергии.
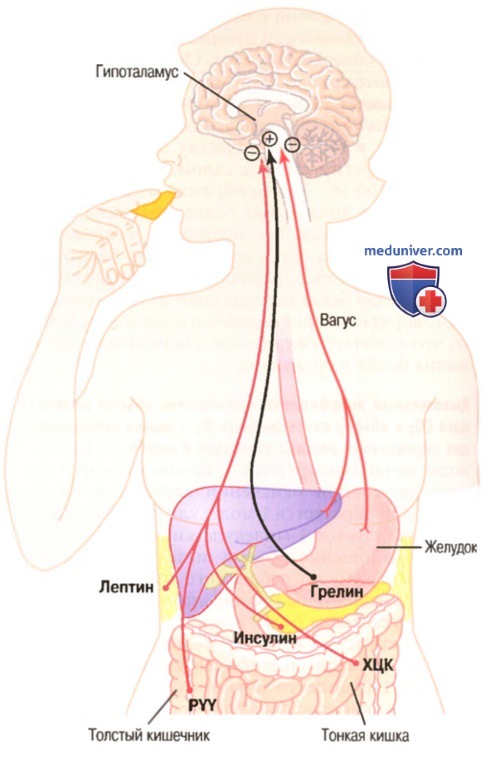
Рецепторы растяжения желудка активируют сенсорные афферентные пути в составе вагуса и ингибируют потребление пищи.
Пептид YY (PYY), холецистокинин (ХЦК) и инсулин являются гастроинтестинальными гормонами, которые выделяются при пищеварении и подавляют дальнейшее потребление пищи.
Грелин, выделяемый желудком, особенно во время голодания, стимулирует аппетит.
Лептин — гормон, продуцируемый жировыми клетками в возрастающих количествах при увеличении их размеров. Он ингибирует потребление пищи
Существуют много общих химических посредников для этих структур гипоталамуса, которые вместе образуют центр, координирующий процессы пищевого поведения и ощущения сытости. Эти ядра гипоталамуса влияют на секрецию гормонов, важных для регуляции энергетического баланса и метаболических процессов, включая гормоны щитовидной железы и надпочечников, наряду с гормонами островкового аппарата поджелудочной железы.
Гипоталамус получает нервные сигналы из желудочно-кишечного тракта о наполнении желудка, химическом составе крови, присутствии в ней питательных веществ (глюкозы, аминокислот, жирных кислот), характеризующих степень на сыщения, а также сигналы от коры головного мозга (вид, вкус, запах), которые обусловливают формирование пищевого поведения. Некоторые из этих информационных входов в гипоталамус показаны на рисунке выше.
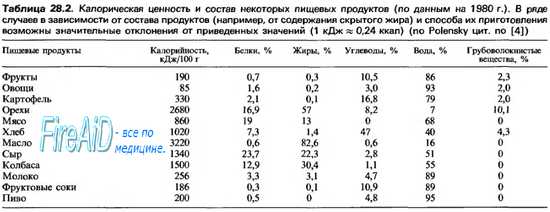
Гипоталамические центры голода и насыщения имеют высокую плотность рецепторов нейромедиаторов и гормонов, регулирующих пищевое поведение. Часть этой многочисленной группы веществ, изменяющих аппетит и пищевое поведение в условиях эксперимента, представлена в таблице ниже, где эти вещества подразделяют на:
(1) орексигенныву стимулирующие пищевое поведение;
(2) анорексигенные, подавляющие пищевое поведение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
От чего зависит аппетит ?
Опубликовано ср, 11/11/2020 — 20:05
Значение аппетита
Аппетит — это строго регулируемое явление, поскольку голод и сытость являются решающими факторами в контроле за потреблением пищи. Нарушения как приема пищи, так и расхода энергии приводят к ожирению — пандемическому синдрому, часто связанному с наиболее распространенными и патологическими заболеваниями , включая болезни сердца, атеросклероз, диабет и рак.
Физиология аппетита
Аппетит регулируется скоординированным взаимодействием кишечника, жировой ткани и мозга. Первичным местом регуляции аппетита является гипоталамус, где взаимодействие между орексигенными нейронами, экспрессирующими нейропептид Y связанный с агути белком, и анорексигенными нейронами, экспрессирующими кокаин про-опиомеланокортин / связанный с амфетамином транскрипт, контролируют энергетический гомеостаз. Было показано, что в гипоталамусе несколько периферических сигналов модулируют активность этих нейронов, в том числе орексигенный пептид грелин и анорексигенные гормоны инсулин и лептин.
Аппетит тесно регулируется скоординированным взаимодействием между периферическими и центральными нервными системами. Две основные группы периферических сигналов информируют мозг об энергетическом состоянии всего тела: краткосрочные сигналы — из желудочно-кишечной системой, и долгосрочные сигналы — от жировой тканью.
Гормоны , регулирующие аппетит
Существует огромное количество анорексигенных гормонов, вызывающих потерю аппетита, секретируемых кишечником; к ним относятся: холецистокинин (CCK) , глюкагоноподобный пептид-1 (GLP-1) , пептид YY (PYY) и оксинтомодулин (OXM). Гормоны, полученные из поджелудочной железы, такие как полипептид поджелудочной железы (PP) , глюкагон , инсулин и амилин , также обладают анорексигенным действием. Наконец, анорексигенные сигналы жировой ткани, такие как лептин , адипонектин и резистин были описаны., как гормоны регулирующие аппетит. С другой стороны, грелин, продуцируемый из кишечника, является единственным примером периферического гормона с орексигенным действием , тем самым повышая аппетит при его высвобождении, обычно перед едой.
Нейротрансмиттеры и аппетит
Глутамат и гамма — аминомаслянная кислота доминируют в синаптической передаче в гипоталамусе, и введение агонистов их рецепторов в ядра гипоталамуса стимулирует аппетит. .
Глутамат
Глутамат является доминирующим возбуждающим нейромедиатором в центральной нервной системе. Чтобы нейрон высвобождал глутамат, нейротрансмиттер должен сначала быть упакован в высоких концентрациях в синаптические везикулы с помощью специфических везикулярных транспортеров глутамата (VGLUT1, VGLUT2 и VGLUT3). При стимуляции, глутамат высвобождается в синаптическую щель , чтобы связать и вызвать воздействие на постсинаптические рецепторы, является ли они ионотропными [ N — метил — d -аспартата (NMDA), д , л -альфа-амино-3-гидрокси-5-метил- изоксазол пропионовая кислота (AMPA), каиновая кислота] или метаботропными рецепторами (mGluR), присутствующими как в нейронах, так и в астроцитах.
Несмотря на повсеместное распространение глутамата его уровни вне клеток жестко регулируются. Высвобождение пресинаптического глутамата значительно превышает количество, необходимое для нейротрансмиссии. Поскольку высокие концентрации глутамата могут препятствовать дальнейшей передаче или стать ассоциированными с нейротоксичными явлениями ( эксайтотоксичность) , если они не устранены быстро, синаптически высвобождаемый глутамат рециркулируется из внеклеточного пространства посредством возбуждающих транспортеров аминокислот, экспрессируемых преимущественно на астроцитах (GLT-1 и GLAST).
В астроцитах рециркулированный глутамат может метаболизироваться до глутамина через глутамин синтетазу или может ассимилироваться в цикле трикарбоновой кислоты (TCA). Глютамин, высвобождаемый из астроцитов, снова поглощается нейронами, где митохондриальный фосфат-специфический фермент — глутаминаза, преобразовывает инертный глутамин в глутамат для последующей переупаковки в синаптические везикулы ( «цикл глутамат-глутамин» ). Синтез глутамата и глутамина de novo астроцитами требует наличия аминогруппы (недавно был предложен аспартат в качестве донора азота нейронов). Согласно гипотезе «лактатного челнока» от астроцитов к нейронам (ANLSH) , энергетические потребности для рециркуляции глутамата, опосредованной астроцитами, обусловлены исключительно гликолитическим метаболизмом глюкозы с сопутствующей продукцией лактата астроцитами, которые становятся основным окислительным топливом для нейронов.
Внутрицеребровентрикулярная инъекция, а также латеральная инъекция в гипоталамус глутамата или его возбуждающих аминокислотных агонистов, каиновой кислоты, AMPA и NMDA быстро вызывают интенсивное потребление пищи. Аналогичным образом, агонисты mGluR5, вводимые интрацеребровентрикулярно, стимулируют питание у грызунов, тогда как антагонист рецептора mGluR5 (R, S) -2-хлор-5-гидроксифенилглицин ингибирует прием пищи.
Астроциты
В последнее десятилетие сообщалось, что астроциты участвуют в нескольких нейроэндокринных процессах, однако , только недавно было установлено их значение в контроле аппетита и энергетического гомеостаза. Астроциты экспрессируют рецепторы для множества нейропептидов, нейротрансмиттеров и факторов роста, производят нейроактивные вещества и экспрессируют ключевые ферменты, необходимые для восприятия и обработки сигналов питания. Например, известно, что анорексигенный гормон лептин влияет на морфологию астроцитов и уровни синаптического белка в гипоталамусе.
Таким образом, предполагается, что наблюдаемое вызванное диетой повышение уровней рецепторов лептина в гипоталамических астроцитах участвует в возникновении ожирения. Совсем недавно Fuente-Martín et al. показали, что лептин напрямую модулирует поглощение глутамата астроцитами в зависимости от времени, стимулируя его быстрое увеличение, которое подавляется хроническим воздействием. Первоначальное быстрое увеличение захвата глутамата астроцитами указывает на то, что лептин может снижать стимулирующие эффекты глутамата на близлежащие синапсы, тем самым снижая аппетит. Кроме того, когда избыток глутамата высвобождается в синаптическую щель, он в конечном итоге повторно захватывается окружающими астроцитами вместе с ионами натрия через астроцитарный котранспортер глутамата — GLAST. В результате внутриклеточные ионы натрия должны быть экструдированы во внеклеточное пространство через электрогенную Na + / K + АТФазу и Na + K + 2Cl -котранспортер, что приводит к внутриклеточному включению ионов калия.
Гамма — аминомаслянная кислота
Стимулирующая роль GABA в регуляции пищевого поведения, контролируемого гипоталамусом, что было доказана в последние годы. Внутрицеребровентрикулярное введение агониста рецептора GABA- А — мусцимола, стимулирует кормление , а ответ блокируется специфическим антагонистом рецептора ГАМК- А — бикукуллином. GABA — ергические входы от нейронов, экспрессирующих AgRP дугообразного ядра, к парабрахиальному ядру необходимы для поддержания критического уровня стимула аппетита.
Лептин
. После еды лептин высвобождается из жировой ткани и связывается с рецептором лептина гипоталамуса, вызывая анорексигенный ответ, заключающийся в сокращении потребления пищи и увеличении расхода энергии. Напротив, в периоды голодания снижение уровня лептина в плазме способствует увеличению потребления пищи и снижению потребления энергии.
Источник